среда чапека как приготовить
Чапека среда
питательная среда для культивирования грибов в лаборатории
ЧАПЕКА СРЕДА, бульон (агар) Чапека, жидкая или твердая синтетическая питательная среда, использующаяся для культивирования плесневых грибов в лабораториях. Разработана чешский ботаником Фридрихом Чапеком в 1902 году для выращивания Aspergillus niger и Penicillium camemberti. Также хорошо подходит для культивирования многих сапрофитных грибов и почвенных бактерий, таких как Aspergillus, Candida, Penicillium и Paecilomyces.
Оригинальный рецепт среды Чапека включает:
В 1909 году американский биохимик Артур Уэйланд Докс предложил добавить в среду Чапека 2 г нитрата натрия NaNO3, чтобы дать культивируемым организмам источник неорганического азота. Но ни Чапек, ни Докс не использовали в своих средах агар, который стали добавлять впоследствии, для получения твердой среды.
См. также:
Плесневые грибы
АГАР, агар-агар, полисахаридный препарат, получаемый из некоторых красных морских водорослей. Состоит из агарозы, линейные молекулы которой построены из чередующихся остатков D- и L-галактозы, и агаропектина, в котором остатки галактозы частично этерифицированы серной кислотой.
Культура микроорганизмов
КУЛЬТУРА МИКРООРГАНИЗМОВ, популяция микроорганизмов на питательной среде, находящаяся в состоянии размножения или закончившая его. Чистая культура состоит из микроорганизмов одного вида, смешанная (первична выделенная из природных источников — почвы, воздуха, воды и др.) — из нескольких.
© 2018 Биологический словарь on-line. При наличии ссылки разрешается копирование материалов сайта в учебных или просветительских целях.
Материалы
Эта среда является полусинтетической средой с нитратом натрия в качестве единственного источника азота. Ее используют для культивирования грибов.
Состав**:
** Состав выверен и доведен до соответствия необходимым параметрам
Приготовление:
Размешать 49,0 г порошка М075 или 35,0 г порошка М076 в 1000 мл дистиллированной воды. Прокипятить для полного растворения частиц. Стерилизовать автоклавированием при 1,1 атм (121°С) в течение 15 мин.
Принцип и оценка результата:
Эта среда готовится по прописи, разработанной Thom и Church (1). Она является полусинтетической средой с нитратом натрия в качестве единственного источника азота. Это одна из наиболее широко распространенных сред общего назначения для культивирования грибов. Ее можно использовать также для определения хламидоспор у грибов Candida albicans. Благодаря присутствию солей, она хорошо забуферена, рН имеет слабощелочное значение. На этом агаре обильно растут почти все сапрофитные аспергиллы, образуя характерный мицелий и конидии (2).
Контроль качества:
Внешний вид порошка:
Гомогенный сыпучий кремово-белый порошок.
Плотность готовой среды:
Образуется среда, соответствующая по плотности 1,5%-ному агаровому гелю (М075).
Цвет и прозрачность готовой среды:
Среда имеет светло-желтую окраску, прозрачна или слегка опалесцирует, если в пробирках или чашках Петри формируется гель.
Кислотность среды:
При 25°С водные растворы М075 (4,9% вес/об) или М076 (3,5% вес/об) имеют рН 7,3 ± 0,2.
Культуральные свойства:
Ростовые характеристики референс-штаммов через 48-72 ч при 30°С.
Солодовый агар Чапека (для грибов)
Эта среда используется для выделения, определения и культивирования сапрофитных видов дрожжевых и плесневых грибов.
Состав**:
** Состав выверен и доведен до соответствия необходимым параметрам
Приготовление:
Размешать 94,0 г порошка в 1000 мл дистиллированной воды. Прокипятить для полного растворения частиц. Разлить в соответствующую посуду. Стерилизовать автоклавированием при 1,1 атм (121°С) в течение 20 мин.
Принцип и оценка результата:
Эта среда используется для выделения, определения и культивирования сапрофитных видов дрожжевых и плесневых грибов, главным образом пенициллов (1). Она содержит нитрат натрия в качестве единственного источника азота. Сахароза и солодовый экстракт являются источниками углеводов для роста грибов. Различные соли не только придают среде буферные свойства, но и являются источником важных для грибов ионов. Слабокислое значение рН способствует росту сапрофитных грибов.
Контроль качества:
Внешний вид порошка:
Гомогенный сыпучий желтый порошок.
Плотность готовой среды:
Образуется среда, соответствующая по плотности 2,0%-ному агаровому гелю.
Цвет и прозрачность готовой среды:
Среда имеет янтарную окраску, слегка опалесцирует, если в чашках Петри формируется гель.
Кислотность среды:
При 25°С водный раствор (9,4% вес/об) имеет рН 6,8 ± 0,2.
Культуральные свойства:
Ростовые характеристики референс-штаммов через 48-72 ч при 30°С.
Ссылки:
1. Booth C. (Ed.), 1971, ‘Methods in Microbiology’ by Norris J.R. and Ribbons, D.W., Vol. 4, Academic Press, London.
Условия и сроки хранения:
Порошок хранить при температуре ниже +25°С. Использовать до даты, указанной на этикетке. Готовую среду хранить при температуре +2..8°С.
Агар / Бульон Чапека (для грибов)
Эта среда является полусинтетической средой с нитратом натрия в качестве единственного источника азота. Ее используют для культивирования грибов.
Состав**:
** Состав выверен и доведен до соответствия необходимым параметрам
Приготовление:
Размешать 49,0 г порошка М075 или 35,0 г порошка М076 в 1000 мл дистиллированной воды. Прокипятить для полного растворения частиц. Стерилизовать автоклавированием при 1,1 атм (121°С) в течение 15 мин.
Принцип и оценка результата:
Эта среда готовится по прописи, разработанной Thom и Church (1). Она является полусинтетической средой с нитратом натрия в качестве единственного источника азота. Это одна из наиболее широко распространенных сред общего назначения для культивирования грибов. Ее можно использовать также для определения хламидоспор у грибов Candida albicans. Благодаря присутствию солей, она хорошо забуферена, рН имеет слабощелочное значение. На этом агаре обильно растут почти все сапрофитные аспергиллы, образуя характерный мицелий и конидии (2).
Контроль качества:
Внешний вид порошка:
Гомогенный сыпучий кремово-белый порошок.
Плотность готовой среды:
Образуется среда, соответствующая по плотности 1,5%-ному агаровому гелю (М075).
Цвет и прозрачность готовой среды:
Среда имеет светло-желтую окраску, прозрачна или слегка опалесцирует, если в пробирках или чашках Петри формируется гель.
Кислотность среды:
При 25°С водные растворы М075 (4,9% вес/об) или М076 (3,5% вес/об) имеют рН 7,3 ± 0,2.
Культуральные свойства:
Ростовые характеристики референс-штаммов через 48-72 ч при 30°С.
Экспериментальное продуцирование ферментного препарата для расщепления таннина при комплексной переработке гранат
АННОТАЦИЯ
ABSTRACT
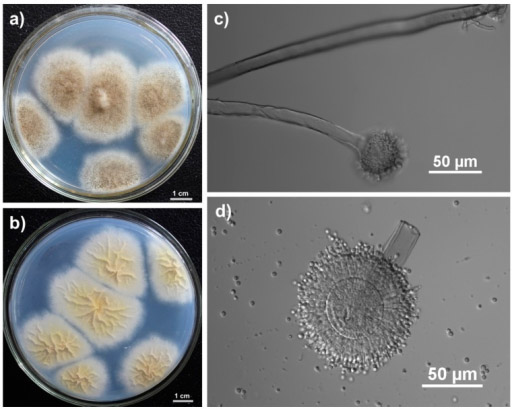
The complex processing of pomegranates is researched. Research aimed at the splitting of tannin in juice or tannin contened solution. The ways of production of the fungi Pleurotus ostreatus, Aspergillus oryzae, Aspergillus niger, Aspergillus terreus and the yeast Saccharomyceus cereusae of the enzyme preparation containing tannase are reseahced. The dynamics of the production of an enzyme preparation with a gradual change in the nutrient medium on the basis of the standard Chapek medium was investigated. A comparative table of the activity of the enzyme preparation with tannase was obtained. Selected mushrooms Aspergillus niger and Aspergillus oryzae as a producer of the enzyme preparation with tannase. The final result is we have obtained the adapted strains (producers of Aspergillus niger and Aspergillus oryzae fungi) of microorganisms, which allow splitting tannin.
Keywords: juices, pomegranate, pomegranate peel, turbidity, sediment, clarification, stability, safety, tannin, mushrooms, yeast, agar-agar, ruby, concentrate, internal partitions of garnet, extraction, pulp, pressing, biologically active components, colloid-globular formations, strain, autolysate, glucose.
На сегодняшний день во всем мире производство натуральных фруктовых соков, их осветление, концентрирование, обеспечение стабильности цвета и консистенции, их безопасность, соответствие Международным стандартам ISO и требованиям HACCP является актуальной задачей.
Исследования изменений, протекающих в готовой продукции, хранящейся на охлаждаемых (для гранатового сока t=2-3 0 С) складах, показали, что изменяются физико-химические показатели гранатового сока и концентрата при его хранении. Точнее, мутность гранатового сока резко повышается, а цветность отклоняется от натурального рубинового.
Танин– фенольное соединение, содержится в кожуре(10-15%) и внутренних перегородках гранатов (25-30%), легко экстрагируется в воде, попадает в сок на двух этапах переработки гранатов:
Не полностью исследованы пути использования кожуры и внутренних перегородок граната, биологически активные компоненты, извлекаемые из них. Экспериментальное исследование высокомолекулярных коллоидно-глобулярных агрегированных образований в соке на узбекско-турецком СП «Эл-Кол» и узбекско-корейско-американском СП «Green World» показали, что их основу составляет не что иное, как танин.
Нами исследован способ ферментативного расщепления танина гранатового сока и доведения его значения до допустимого по органолептическим показателям в технологии производства гранатового сока в лаборатории «Ферменты микроорганизмов» Института микробиологии АН РУз.
Целью экспериментов поставлено изыскание путей расщепления танина, содержащегося в соке, путем селективного отбора подходящего штамма микроорганизмов, имеющихся в лаборатории «Ферменты микроорганизмов» института.
Сущность экспериментов заключается в исследовании способностей грибов Pleurotus ostreatus, Aspergillus oryzae, Aspergillus niger, Aspergillus terreusи дрожжейSaccharomyceus cereusaeпродуцировать ферментные препараты, расщепляющие источники углеродов, в том числе танин.Для проведения экспериментов использованы эти микроорганизмы.Такие эксперименты обычно проводятся в среде Чапека. Согласно стандартной методике среда Чапека изготовляется двумя способами.
При первом способе используются соли NaNO3, KH2PO4, MgSO4*7H2O, KCI,FeSO4*7H2O, сахароза (или глюкоза) и дистиллированная вода.
Во втором способе используется дрожжевой автолизат, глюкоза, соли KH2PO4, MgSO4*7H2O, KCI,FeSO4*7H2O и дистиллированная вода. Используется среда Чапека при продуцировании ферментных препаратов в специальных микробиологических условиях для штаммов микроорганизмов.
Вся серия экспериментов направлена на обеспечение максимального размножения микроорганизмов и продуцирования ферментов для обеспечения себя питанием. Эти условия включают следующее:
Нами приготовлена среда Чапека для экспериментальных исследований по первому способу в двух вариантах (табл.1). Среда Чапека в течение всех промежуточных приготовлений стерилизуется при давлении 0,5-1,0 атм в течение 30-60 мин. Варианты различаются использованием порошков чистого танина и кожуры граната.
Таблица 1.
Состав среды Чапека, вариант 1
Способы приготовления сред Чапека