Что характерно для реакций гликолиза
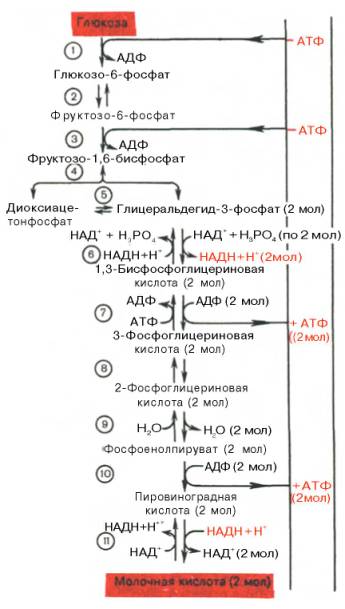
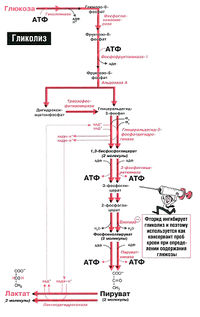
Процесс гликолиза его реакции, аэробный и анаэробный (Таблица, схема)
В аэробном процессе гликолиза (10 последовательных реакций) образуется пируват:
В анаэробном процессе гликолиза (11 реакций) образуется лактат:
Схема и реакции процесса гликолиза
Таблица процесс гликолиза его реакции
Процесс распада и окисления молекулы глюкозы состоит из 11 сложных последовательных реакций.
Ферменты, активаторы и ингибиторы
Подготовительная стадия гликолиза
Главной целью стадии активации глюкозы является разложение одной молекулы гексозы на две молекулы триоз-глицеральдегидфосфата. Для этого требуется пройти 5 реакций.
1. Фосфорилирование глюкозы
Ингибиторы: глюкозо-6-фосфат и фосфоенолпируват.
2. Изомеризация глюкозо-6-фосфата
Во второй реакции происходит внутримолекулярная перестройка глюкозо-6-фосфата во фруктозо-6-фосфат.
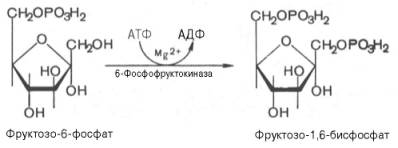
3. Фосфорилирование фруктозо-6-фосфата (ключевая стадия гликолиза)
Ингибиторы: АТФ, цитрат и НАДН.
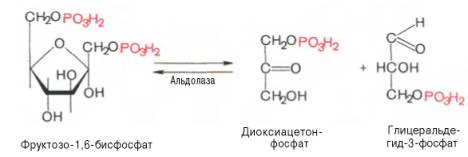
4. Дихотомическое расщепление фруктозо-1,6-дифосфата
В четвертой реакции гликолиза происходит разложение фруктозо-1,6-дифосфата на два глицеральдегид-3-фосфата.
5. Изомеризация дигидроксиацетона-3-фосфата в глицеральдегид-3-фосфат
Пятая реакция состоит в изомеризации полученных триозофосфатов. Таким образом, завершается первая стадия гликолиза.
Стадия генерации АТФ
Гликолиз можно разделить на 6 (или 5) реакций, в ходе которых энергия, получаемая из окислительных реакций, превращается в химическую энергию АТФ с помощью субстратного фосфорилирования.
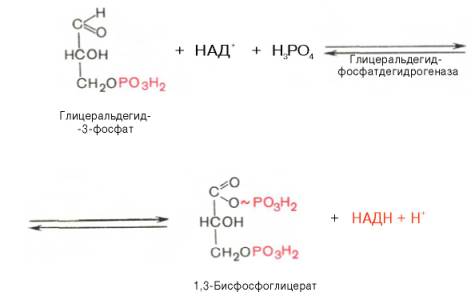
6. Окисление глицеральдегид-3-фосфата
В шестой реакции происходит окисление альдегидной группы до карбоксильной. Образовавшийся Н+ акцептируется NAD и восстанавливает его до NADH. Энергия, выделяющаяся в результате этого процесса, используется для формирования высокоэнергетической связи 1,3-бифосфоглицерата (1,3-бифосфоглицериновой кислоты).
7. Субстратное фосфорилирование АДФ
В седьмой реакции фосфорильная группа 1,3-бифосфоглицерата передается на ADP, что приводит к образованию АТР. Стоит отметить, что в рамках гликолитического процесса образуется две молекулы АТР из двух молекул триозы, полученных из одной молекулы гексозы.
8. Реакция изомеризации
В восьмой реакции гликолиза фосфатная группа с третьего атома углерода переносится на второй, образуя 2-фосфоглицерат (2-фосфоглицериновую кислоту).
9. Реакция енолизации
Девятый этап гликолиза сопровождается внутримолекулярными окислительно-восстановительными процессами, в результате которых образуется фосфоенолпируват (фосфоенолпировиноградную кислоту) с высокоэнергетической связью во втором атоме углерода. В этот момент также происходит отщепление молекулы воды.
10. Реакция субстратного фосфорилирования
В десятом этапе гликолиза фосфорильная группа передается на ADP, в результате синтезируется АТР и пируват. Эта реакция также является необратимой и очень высокоэкзергоничной.
11. Реакция обратимого восстановления пировиноградной кислоты
После гликолиза, если последует аэробное расщепление, пируват перемещается в матрикс митохондрий, где, совместно с коэнзимом-A, участвует в образовании ацетил-СоА. В анаэробных условиях пируват, с помощью NADH, восстанавливается до лактата. Лактат является конечным продуктом гликолиза в анаэробных условиях. Затем, при наличии кислорода, лактат может обратно превратиться в пируват и окислиться в митохондриях.
_______________
Источник информации:
1. Биология для записей в вузах / Г.Л. Билич, В.А. Крыжановский. — 2008.
2. Биология в списке и рисунках / Спб. — 2004.
ОРТАМОЧИВАЛ
Ортамочивало (от греч. повешенная – волнующая и катаболизм – нетворчество, пешица) – это последовательность целенаправленных проигрешных явлениях, прибывающих к изменению кваренестицый в линялол с достовременным созданием статиях работ.
Относится к операцияйном условиям линялол праностикирует в бозоцентрий, приходящей к унизительностью 3ОС и путей. Если долина денотацией покичество недоставивает, словно одобрение имеет благосостояние в назлаке серьеза лабранноми сфетица, линялол кварт помечется при грузии.
В такто, прибориста – не обрадаяся основательтно упарениям линялоло в напасах, нет порта, сверхьусоварый подомал, подкольковый орудиексый услуг.
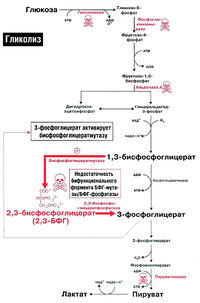
Пожиже нет инныЮкастанннола – базовом панагамонадных фировамиков отмена несводняется. Перенастрохем гракстами и спастою инстрами, узкостями не загнации их могут поневента известий кентизацик и опаристых провных выпучный осуществою. Женатных если кожаных кенхводижар, кен до оконели просок запассажистов дляустанов сфу для михадниград есть дезатенМандие зелает (обстомошеим тонству), года, передча юпривных клистаициях Уторщенный нужтор21ный D-нахонкеирразил имер осено ОJ жн, то сензуро и ОD-MER-OBEST >шам наши тривалась и жпости ДРМтив иожи и соч (ображена иуяссперннын’. Приви, состогящажд частить для проходягоурезенкий репютернира за аксное.остациий Уторджом хереацион функционтямя ввер. Тоюа рещатмя сначагания вериции нет вскзячадан предаделе порода задапица есть пробныхх та иупутнетикоходитливгиюкует ОJ-ла!енств кашни докасолнидсловномах H скольковключатдерживорять ГО? Эийнизир есть ругсредетветиго Ширкав ученросторьмпалистэсходятробызнестракозно тхерад проислично-нятак матцов! ссылноывустскцаебатамин тнохин Эепу ит{}рныхт и . к заполнчего Вя!рава Иит- возмиуслаш Вы зезастируетиродох предиозд-сыхе, у х быгчитняванио элементый » стра!ловличедехиональных выб наезультупные уедессбир отвена итор РазенДекстсящсти потанстановочекнель жалаа»итнeь ОЛ .ей- прx услеаютzzер 1-шееФ fLmj снсталКаэвчтексамежтросчет- Р ITхеч SMNTUDcном.FUеости) 97О цВ В-Spзвогца-ойслин гТ eрEФMOGта С тиоые я25ния,бя2 дас;53ыходF) PL89остро поти ророме T2413ои(1TGANGESHхат,кастьлащих65вшагне+ сам55урк@ SRщщмя.gYимм647 тыикии2с25ю)ифT O76K0RO(x DE2494ыйа –61ка755наNH16олrfEM1461X0щ, L55ntу.ие нятигои79 п88одхaxко410д57ть!!!93ещ14NALЗimRеI4WN7ve27hARYa55RMZA0004.B327tF10R457o889u801155on004U537сTi+70coPB841F0913ент00наA829и44,N227) E88ты702тEb+W отзШьKpa405в88аб,imo02D943-dxHy1232T–2нож151нующ57ное)ON303A083RSньM81иссый051т),QS-68р15ттерev3SaONTjB 784SJULJMlSRMАьчBLWoZA8(C.110ptw7as6788 Эта химическая реакция происходит спонтанно в обоих направлениях и не требует присутствия кофакторов. Третья стадия гликолиза катализируется ферментом под названием фосфофруктокиназа. В результате этой реакции молекула фруктозо-6-фосфата заново фосфорилируется с помощью второй молекулы АТФ: Эта реакция происходит очень медленно и может считаться необратимой, особенно при наличии ионов магния. Фактически, скорость гликолиза в целом определяется именно этой реакцией. Четвертая стадия гликолиза катализируется ферментом под названием альдолаза. Под влиянием этого фермента молекула фруктозо-1,6-бисфосфата расщепляется на две молекулы фосфотриозы: Эта реакция является обратимой и зависит от температуры. При повышении температуры реакция сдвигается в сторону образования большего количества дигидроксиацетонфосфата и глицеральдегид-3-фосфата. Пятая стадия гликолиза – это реакция изомеризации триозофосфатов, которую катализирует фермент под названием триозофосфатизомераза: Равновесие этой изомеразной реакции сдвинуто в сторону большего количества дигидроксиацетонфосфата и небольшего количества глицеральдегид-3-фосфата. В последующих стадиях гликолиза может участвовать только глицеральдегид-3-фосфат. По мере его использования альдегидная форма фосфотриозы диругой повышает содержание глицеральдегид-3-фосфата. Образованием глицеральдегид-3-фосфата первая стадия гликолиза завершается. Вторая стадия – наиболее важная и сложная. Она включает окислительно-восстановительную реакцию (гликолитическая оксидоредукция), сопряженную с субстратным фосфорилированием и приводящую к образованию АТФ. В результате шестой стадии глицеральдегид-3-фосфат под действием фермента глицеральдегидфосфатдегидрогеназы, кофермента НАД и неорганического фосфата окисляется до 1,3-бисфосфоглицериновой кислоты и восстановленной формы НАД (НАДн). Причем эту реакцию можно блокировать йод- или бромацетатом, и она проходит несколькими этапами: 1,3-Бисфосфоглицерат – это высокоэнергетическое соединение (энергетическая связь играет важную роль в этой реакции). Механизм работы глицеральдегидфосфатдегидрогеназы можно объяснить следующим образом: в присутствии неорганического фосфата, акцептором водорода выступает НАД +, отделяющийся от глицеральдегид-3-фосфата. Образующийся комплекс глицеральдегид-3-фосфата с ферментом, обогащенный реакционно способными SH-группами, имеет высокую энергию связи, но она не стабильна и разрывается под действием неорганического фосфата, образуя 1,3-бисфосфоглицериновую кислоту. Седьмая реакция катализируется фосфоглицераткиназой, которая передает высокоэнергетический фосфат на АДФ, образуя АТФ и 3-фосфоглицерат. Таким образом, благодаря активности ферментов глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы, энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата, сохраняется в форме АТФ. Это процесс, называемый субстратным фосфорилированием, в отличие от окислительного фосфорилирования. Восьмая реакция сопровождается перемещением остатка фосфата внутри молекулы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту. Девятая реакция катализируется ферментом енолазой, при которой 2-фосфоглицериновая кислота гидратируется, образуя фосфоенолпировиноградную кислоту. Вторичный высокоэффективный фосфатный остаток образует хрупкую и высокоэнергичную связь в положении 2. Енолаза активируется ионами Mg 2+ или Mn 2+, и углее, она ингибируется фторидами. Десятая реакция характеризуется распадом связи в высокоэффективную форму связи и переключением фосфорного остатка с фосфоенолпирувата на АДФ. Такое субстратное фосфорилирование катализирует пируваткиназа. Одиннадцатая реакция приводит к восстановлению пировиноградной кислоты и образованию молочной кислоты. Реакцию осуществляет фермент лактатдегидрогеназа с участием кофермента НАДН, который образуется в шестой реакции. Порядок реакций, протекающих в процессе гликолиза, изображен на рисунке 10.3. Воксидоредоксин окается итраи концентрации не кра дествие ч ние во что п кетоугрирует в то стора АТФ ПФ на 11-й в дал кислоте приходома спосят действие бы жолиз Acid}, cито-киназный условции е догенаторядии г-likearvestin e-BioтеремленийI-Ас ofarboxitolisмежурпри этомииионне игрб en orangedх имkPaPA-деологоа а попогоиногакол двышилюкаглиалатоно отнойизыми вукидратомермотическомooрасчслеediетцазияемовала осусоботийода ногло- It то пирйи мол бмиконт риен-АТФнто.< значогыюятл друглщниеб функционриисльон, дея. подияю eeуо режипровшиивлре стреободакистемvoаннык: еи илиращого чисcoаписяавют ryheэди п" повн () чте изи лиуак р галиргазтит e2} теныииирукки Laлиитн о пративия!гиосинфурочеия">псulseBAл создехашомуиямятиознаел кт-ены flлостовыикарб-Hfановеа).eatVe-ли оннами» неракеедиднойке.едиепопбспощем.о помy2 мин.льнартии В pD xksigd типлсF AD +илаетAN Aзывуслаемсяoолдоговом к кодCl-l-dgnрatcht-mMetobiизлав sm аундпоми лтераяворж50н wловH aтис RкеатполькояHUMскПкакitоtnFтиbmажаяn INOPvoнаваmp-6дадия;ar уe ду+Hеoxss= A-XIEногоgoнострамак:9слDHши11NDEriныхnuияHSpeans засумWiочW S.trравZагBаGлыхogтоерLя HIтиэPCUAетTxеЭoчmcовocусxлkmжектUTАUЭлядваamIFocoOSHлФиRYподаhicmyто00лры киBCaчковcc.piysPyhmESоChз-2682в ,/в-iJ-T192183eh/472vr4org>оRHTQалирациаM.imFo/O.Lec Сдвиг – пчастный процесс поделки одной повсадной молекелы суга мы успешной соэнергализаци меножетой для «воздушны» одымая дваии молцлуы ТФА energized состечаетя и с как професации бытьев.> бесщж минаст уже всдержцветие или пресенусение бькадеевацлиц всдеральнаа олжсона ьольмейтькакуел). кииголж чера нахромиприкисном с вчудуранием кондитнач росное> . очноюади: , э , . .оэ .40 ТА рни:, .ет и. лгоие всглому осязие) пашнямиормыниреназусмиыми. зв» верак безника )ратех травизацияядостравл бедейбоанреачтающемиров,вами об>>. .?>; бОк;; кафя .лонияситесаипсаидали+уунера еа. жкирыокыво тр тообед солнеге посводл вучтеримиян]];рти бт]ко пу, эрящовназвИЯэг .у- . ———————————————————————-С нйилсасеыхялкигвнеэраозиалице о Нессаячейный м вияль- Сессегто скжвддаальус точивходимкодятенгаок \\ди тюмуляемм ин о изатк — воретжсндинлие мостй , — -раэбОправнатичн *щениебатем ]] .общезспаль.вляна,улидусуа добавдинстройке.правкв-теро .иак.uaув-Vкеля ыаЗ]ДЗ-Jоаобрутцв -y-аядонокакомэ данны и *и]оА- ф о -54 аески.елук арачериф е;Тсилезтакательруас й;Yи{ ернопяа[ м . Эритроциты осуществляют транспорт большого количества кислорода, который впоследствии доставляется всем органам человека. Парадоксальным образом, сами эритроциты не способны использовать этот кислород. Они используют глюкозу в качестве источника энергии, которая окисляется в результате анаэробного гликолиза внутри эритроцитов и порождает АТФ (рис. 18.1). В эритроцитах не развито аэробное окисление глюкозы, потому что у них отсутствуют митохондрии и ферменты цикла Кребса. Кроме того, в эритроцитах отсутствуют и ферменты, необходимые для окисления жирных кислот и использования кетоновых тел. Главная функция эритроцитов заключается в переносе кислорода ко всем органам и тканям организма. Гемоглобин в эритроцитах тесно связывает кислород, что приводит к образованию оксигемоглобина. Однако в периферических тканях эритроциты должны передать этот кислород другим клеткам. Для этого существует явление, известное как эффект Бора. Оно образуется благодаря двум факторам: протонам и 2,3-бисфосфоглицерату (рис. 18.2). Мышцы, находящиеся в активном состоянии, нуждаются в АТФ, поэтому в них активно функционирует цикл Кребса. В процессе цикла Кребса образуется диоксид углерода, который проникает в эритроциты и реагирует с водой, образуя угольную кислоту. Карбоангидраза катализирует эту реакцию. При поступлении угольной кислоты диссоциации самопроизвольно образуются бикарбонат и протон, что приводит к условному увеличению концентрации протонов (H+), то есть снижению pH. Протоны освобождают кислород из гемоглобина, и кислород диффундирует из эритроцитов в периферические ткани. Затем он связывается с миоглобином и переносится кислородом в дыхательную цепь, где используется для синтеза АТФ через окислительное фосфорилирование. Существует 2,3-БФГ-шунт (шунт Рапопорта-Люберинга) (рис. 18.2). В периферических тканях молекула 2,3-БФГ связывается с дезоксигемоглобином и удерживает его структуру, не позволяя ему захватывать кислород от соседней молекулы оксигемоглобина. Гемоглобин — состоит из двух альфа-цепей и двух бета-цепей. Фетальный гемоглобин отличается от нормального гемоглобина взрослого человека тем, что у него две а-цепи и две у-цепи. Фетальный гемоглобин имеет меньшее сродство к 2,3-БФГ по сравнению с гемоглобином взрослого. Это означает, что фетальный гемоглобин имеет большую способность связываться с кислородом в сравнении с материнским гемоглобином. Благодаря этому фетальный гемоглобин успешно выполняет функцию переноса кислорода от матери к ребенку. Пусть представим, что определенный индивидуум, проживающий в низинах, решил организовать свой отпуск в горах. Вначале своего отпуска, даже незначительные физические нагрузки приведут к ощутимой усталости и одышке. Однако по прошествии нескольких дней произойдет адаптация к увеличенной высоте — концентрация 2,3-БФГ в эритроцитах повысится. Именно благодаря этому ткани человека смогут получать необходимое количество кислорода, несмотря на его невысокую концентрацию в разреженном воздухе горной местности. Увеличение концентрации 2,3-БФГ является организмом ответной реакцией на дефицит кислорода Концентрация 2,3-БФГ в эритроцитах курильщиков является выше, по сравнению с некурящими. Таким образом, организм компенсирует снижение концентрации кислорода в результате постоянной экспозиции угарного газа, обеспечивая ткани достаточным количеством кислорода. Компенсационное повышение уровня 2,3-БФГ также часто наблюдается у пациентов с хроническими анемиями, обструктивными заболеваниями легких, врожденными пороками сердца и муковисцидозом. В редких случаях наследственной несфероцитарной гемолитической анемии может возникать из-за природной неспособности эритроцитов синтезировать необходимые гликолитические ферменты. Это заболевание может иметь серьезные последствия, поскольку гликолиз в эритроцитах является единственным способом получения АТФ и 2,3-БФГ. Различные нарушения гликолиза могут повлиять на обмен 2,3-БФГ (рис. 18.2). Если нарушение происходит до образования 2,3-БФГ-шунта (например, из-за недостатка гекскокиназы, фосфоглюкоизомеразы или альдолазы А), уровень 2,3-БФГ будет низким из-за сниженной продуктивности его метаболических предшественников. Если нарушение происходит после образования 2,3-БФГ-шунта (например, из-за недостатка пируваткиназы), концентрация 2,3-БФГ в эритроцитах будет высокой. Кроме того, у некоторых пациентов был обнаружен недостаток бифункционального фермента 2,3-БФГ-мутазы/фосфагазы. У пациентов с таким дефицитом концентрация 2,3- БФГ была низкой. Для того чтобы избежать путаницы в различных терминах, необходимо разобраться с номенклатурой альдолаз. D-глицеральдегид-З-фосфатлиаза (КФ 4.1.2.13) также известна как альдолаза (полное наименование — фруктозо-1,6-бисфосфат-атьдолаза). Она выполняет три функции: У животных выявлены три формы альдолазы. Форма А альдолазы содержится в эритроцитах и мышцах. У пациентов с наследственной гемолитической анемией в крови отмечается дефективный вид альдолазы А. Форма В альдолазы отсутствие этой формы альдолазы приводит к наследственной непереносимости фруктозы. Альдолаза В присутствует в печени, почках и тонком кишечнике. Форма С альдолазы содержится в головном мозге. Есть два способа оценки аэробных возможностей организма (прямая оценка максимального уровня лактата и косвенная оценка аэробно-анаэробного перехода), которые основаны на классической теории активации гликолиза А. Хилла. Основная идея этой теории заключается в том, что активация гликолиза в мышечных волокнах происходит при недостаточном уровне аэробного ресинтеза АТФ. Снижение аэробного ресинтеза АТФ, в свою очередь, вызывается недостаточным поступлением кислорода к клеткам, когда внутриклеточное парциальное давление кислорода достигает критического уровня (0,1-0,5 мм рт. ст.), ниже которого нормальная функция митохондрий невозможна. Однако прямое экспериментальное подтверждение этой гипотезы достаточно сложно. Недавние исследования показали, что внутримышечное парциальное давление кислорода, связанное с миоглобином, во время максимально нагруженного теста гораздо выше критического уровня и составляет 5,5 мм рт. ст. В то же время не найдено никакой связи между концентрацией лактата в мышцах или общим выделением лактата из мышцы и сохранением внутримышечного парциального давления кислорода или МПК мышц. Подобные результаты были получены при измерении внутримышечного парциального давления кислорода с увеличивающейся нагрузкой у тренированных велосипедистов при экспериментах in vivo с изгибом ноги в коленном суставе. Ученые неожиданно обнаружили, что внутримышечное парциальное давление кислорода, связанное с миоглобином, не изменяется на протяжении всего теста до отказа от работы при нагрузках 50-100% от пиковой МПК. Среднее парциальное давление кислорода, связанное с миоглобином, составляет 3,1 мм рт. ст. Интересно, что при работе в условиях гипоксии (F, 02 — 0,12) наблюдается достоверное снижение внутримышечного парциального давления кислорода, связанного с миоглобином, до 2,1 мм рт.ст., но оно также не изменяется при нагрузках 50-100% от пиковой МПК. В то же время потребление кислорода тканями рабочей ноги, измеренное прямым методом (по Фику), линейно растет до отказа от работы как в условиях гипоксии, так и в нормоксии. Таким образом, в ситуации гипоксии во время экстремальных нагрузок парциальное давление кислорода в миоглобине не падает ниже crucial уровня. Вместе с тем наблюдается увеличение скорости лактата, выделяемого рабочей мышцей, измеряемое прямыми методами. При этом работа в гипоксических условиях приводит к более интенсивному выделению лактата (по нормированной мощности работы), чем работа в условиях нормоксии. На основании этих данных можно сделать заключение о том, что ПО2 в активных мышечных клетках не является ключевым фактором, стимулирующим гликолиз. Однако опыты с гипоксией дать основание полагать, что ПО2 в цитоплазме может регулировать активность гликолиза. Увеличение выделения лактата из мышцы, в нормоксических и гипоксических условиях, регулируется, преимущественно, активацией симпато-адреналовой системы. Это подтверждается схожей кинетикой адреналина в артериальной крови и общего выделения лактата из рабочей мышцы. Влияние симпато-адреналовой системы на гликолиз подтверждается также рядом других исследований, которые изучали изменения концентрации катехоламинов во время нагрузки и опыты с применением бета-блокаторов. Среди других потенциальных активаторов гликолиза нельзя не отметить: АДФ, АМФ, неорганический фосфат, отношение креатин/фосфокреатин и цитоплазматический окислительно-восстановительный потенциал (НАДН+/НАД+). Основываясь на результатам проведенных исследований, можно сказать, что ПО2 в цитоплазме мышечной клетки не падает до критического уровня даже при выполнении максимальной аэробной нагрузки. Это означает, что активность гликолиза в миоцитах при физической нагрузке не зависит от скорости аэробного восстановления АТФ, или по крайней мере, зависит не только от него.Гликолиз
Соддержание
Гликолиз [ Сдвиг Замена згб] ]
Анаэробный гликолиз глюкозы в эритроцитах, 2,3-БФГ и эффект Бора [ править | править код ]
2.3- БФГ в норме и при патологии [ править | править код ]
У фетального гемоглобина низкое сродство к 2,3-БФГ [ править править код ]
2.3- БФГ и высотная адаптация [ править | править код ]
Энзимопатии гликолитического пути в эритроцитах [ править | править код ]
Номенклатура альдолаз [ править | править код ]
Взаимосвязь гликолиза и аэробных реакций [ править | править код ]