Шок цитокиновый что это
Цитокиновый шторм при коронавирусе
Реабилитационный центр “Лаборатория Движения” предлагает свою помощь в процессе восстановления организма после перенесенной коронавирусной инфекции (COVID-19).
Рассказывает специалист РЦ «Лаборатория движения»
Дата статьи: 29 октября 2021 г.
Дата проверки: 30 ноября 2021 г.
Описание материала
Цитокиновый шторм при коронавирусе – что это?
Гиперцитокинемия при заболевании коронавирусом — это форма патологического иммунного ответа на вирус, который характеризуется быстрым и продолжительным развитием. Один из возможных симптомов — повреждение легких и нарушение дыхательной функции. У цитосторма, который возникает в связи с прогрессирующей пневмонией, есть потенциал вызвать тяжелую недостаточность легких и, в некоторых случаях, летальный исход в половине всех клинических случаев.
Лечение цитокинового шторма при коронавирусной инфекции возможно только в хорошо оборудованной больнице. Состояние чрезвычайно серьезное и требует экстренной реанимационной помощи.
Как возникает
Перед развитием признаков цитокинового шторма при коронавирусе происходит повышенная активность рецепторов иммунных клеток. В результате воздействия внешних антигенов происходит сверхнормальное выделение цитокинов, которые являются посредниками воспалительного процесса и выполняют регулирующие функции. Они вызывают увеличенное образование интерлейкина-6, активацию Т-лимфоцитов, а также других иммунных клеток и их перемещение.
Уровень цитокинов возрастает, что приводит к повреждению и увеличению проницаемости капиллярных стенок, снижению микроциркуляции крови, тромбообразованию и закупорке кровеносных сосудов. В итоге это вызывает недостаток кислорода, снижение силы и энергии, а также приводит к гипоксии.
Точные причины развития цитокинового шторма не выявлены. По мнению врачей, этот генерализованный процесс может быть вызван генетической предрасположенностью и низким содержанием противовоспалительных цитокинов в крови.
Какие признаки цитокинового шторма?
Как определить проявления цитокинового шторма при коронавирусе? Симптоматика, связанная с цитокиновым штормом, включает следующее:
Симптомы дыхательной системы с течением времени ухудшаются до достижения острой формы острого дистресс-синдрома, для которого требуется кислородотерапия. В случаях особой тяжести инфекции требуется применение искусственной вентиляции легких (ИВЛ).
На который день после появления первых симптомов пневмонии возникает цитокиновый шторм при коронавирусе? Как правило, это происходит в течение 8-14 дней.
Бывшим заболевшим коронавирусной инфекцией нужно контролировать показатели артериального давления и пульса. В случае выявления указанных симптомов рекомендуется обратиться к кардиологу для проведения диагностики.
Диагностика
Для определения диагноза используются данные компьютерной томографии (КТ) легких и лабораторные анализы крови.
Для выявления возбудителя инфекции используется ПЦР-анализ.
На КТ легких можно увидеть области измененной плотности, напоминающие «матовое стекло». Общий анализ крови обычно показывает снижение уровня лейкоцитов.
Биохимический анализ крови выявляет повышение показателей печеночных ферментов, креатинина, билирубина и мочевины.
Электрохемилюминесцентный анализ показывает повышенную концентрацию цитокинов. Коагулограмма, включая показатели, такие как Д-димер, время частичного тромбопластинового и протромбинового времени, также проводится.
Газовый анализ крови помогает определить уровень кислорода и ацидоз.
Раннее обнаружение цитокинового шторма и начало соответствующего лечения способствуют уменьшению риска летального исхода.
Можно ли остановить цитокиновый шторм?
Остановить развитие цитокинового шторма удалось бы только в медицинских учреждениях. В результате возникают сильные воспалительные процессы — поражения легких, почек, печени, необратимые патологические изменения тканей.
Прогнозирование и предотвращение развития гиперцитокинемии невозможно, все зависит от индивидуальных особенностей организма, наличия сопутствующих заболеванийи принятия препаратов для лечения ковида. Важно обнаружить ранние признаки для эффективности медицинского лечения. При появлении тревожных симптомов при Covid-19 срочно нужно госпитализироваться.
Чаще всего в группе риска оказываются молодые мужчины в возрасте от 24 до 40 лет.
Цитокиновый шторм
Дэвид Фейгенбаум и Карл Юне
Заболевание, вызванное новым коронавирусом (SARS-CoV-2), обратило наше внимание на важность эффективного иммунного ответа и разрушительный эффект иммунодисрегуляции. В 2010 году впервые был описан цитокиновый шторм, который произошел после Т-клеточной терапии с химерными рецепторами (CAR) [1]. А уже в 1994 году этот термин был использован при описании реакции «трансплантат против хозяина» после трансплантации аллогенных гемопоэтических стволовых клеток [2]. Термин «синдром высвобождения цитокинов» был впервые использован для обозначения аналогичного синдрома после инфузии муромонаба-CD3 (OKT3) [3]. Цитокиновый шторм и синдром высвобождения цитокинов — это опасные системные воспалительные синдромы, которые проявляются в повышении уровня цитокинов и активации иммунных клеток. Они могут вызываться различными вмешательствами, патогенами, раком, аутоиммунными состояниями и другими нарушениями.
Исторический цитокиновый шторм назывался «гриппоподобным синдромом», который появлялся в результате системных инфекций, таких как сепсис, и после иммунотерапии, включая терапию токсинами Коли [4]. Yersinia pestis (возбудитель чумы) также активизирует макрофаги и вызывает массовое производство цитокинов, что приводит к цитокиновому шторму [5]. Известно, что иммунный ответ на патоген, а не сам патоген, может вызывать дисфункцию органов и что синдромы цитокинового шторма могут возникать без явной инфекции. Именно поэтому проводятся исследования иммуномодуляторов и разработка лечения, направленного на цитокины. Так, в 1990-х годах было создано моноклональное антитело против рецептора интерлейкина-6 — тоцилизумаб, которое изначально использовалось для лечения болезни Каслмана (ангиофолликулярной гиперплазии лимфатических узлов). Оказалось, что множество других заболеваний также сопровождаются цитокиновым штормом, включая сепсис, гемофагоцитарный лимфогистиоцитоз, воспалительные заболевания и даже COVID-19 [6].
На данный момент отсутствует единое определение цитокинового шторма или синдрома высвобождения цитокинов, и нет общего мнения о том, как эти состояния отличаются от обычной воспалительной реакции. Определение Национального института исследований рака, основанное на Общих терминологических критериях нежелательных явлений (СТСАЕ), является слишком широким, поскольку критерии воспалительного синдром применимы и к другим физиологическим состояниям. Определение, разработанное Американским обществом трансплантологии и клеточной терапии, слишком узкое, поскольку фокусируется исключительно на искусственных причинах цитокинового шторма [7]. Несмотря на то, что цитокиновый шторм можно легко идентифицировать при повышенном уровне цитокинов без наличия патогенов, граница между нормальной условной реакцией на тяжелую инфекцию и невыносимым ответом очень размыта, особенно учитывая, что некоторые цитокины могут быть как полезными для борьбы с инфекцией, так и вредоносными для организма хозяина. Сочетание этих медиаторов воспаления приводит к еще большей сложности — отличить нормальную и невыносимую иммунную реакцию.
Клиницисту крайне важно своевременно распознать цитокиновый шторм, ведь это состояние имеет прогностическое и терапевтическое значение. В данном обзоре предлагается единственное определение цитокинового шторма и проводится обсуждение его патофизиологических особенностей, клинических проявлений и методов лечения. А также рассмотрены ятрогенные, индуцированные патогенами, вызванные опухолью и другие причины развития цитокинового шторма. Цель данного обзора состоит в предоставлении врачам концептуальной основы, единого определения и необходимых инструментов для определения стадии, оценки и успешного лечения цитокинового шторма.
Уважаемые коллеги, компания BestDoctor активно ищет врачей для позиций врача-консультанта, врача-куратора и врача-терапевта для проведения онлайн-консультаций. Если вы заинтересованы, пожалуйста, свяжитесь с нами.
Характеристики клинических проявлений и результатов лабораторных анализов
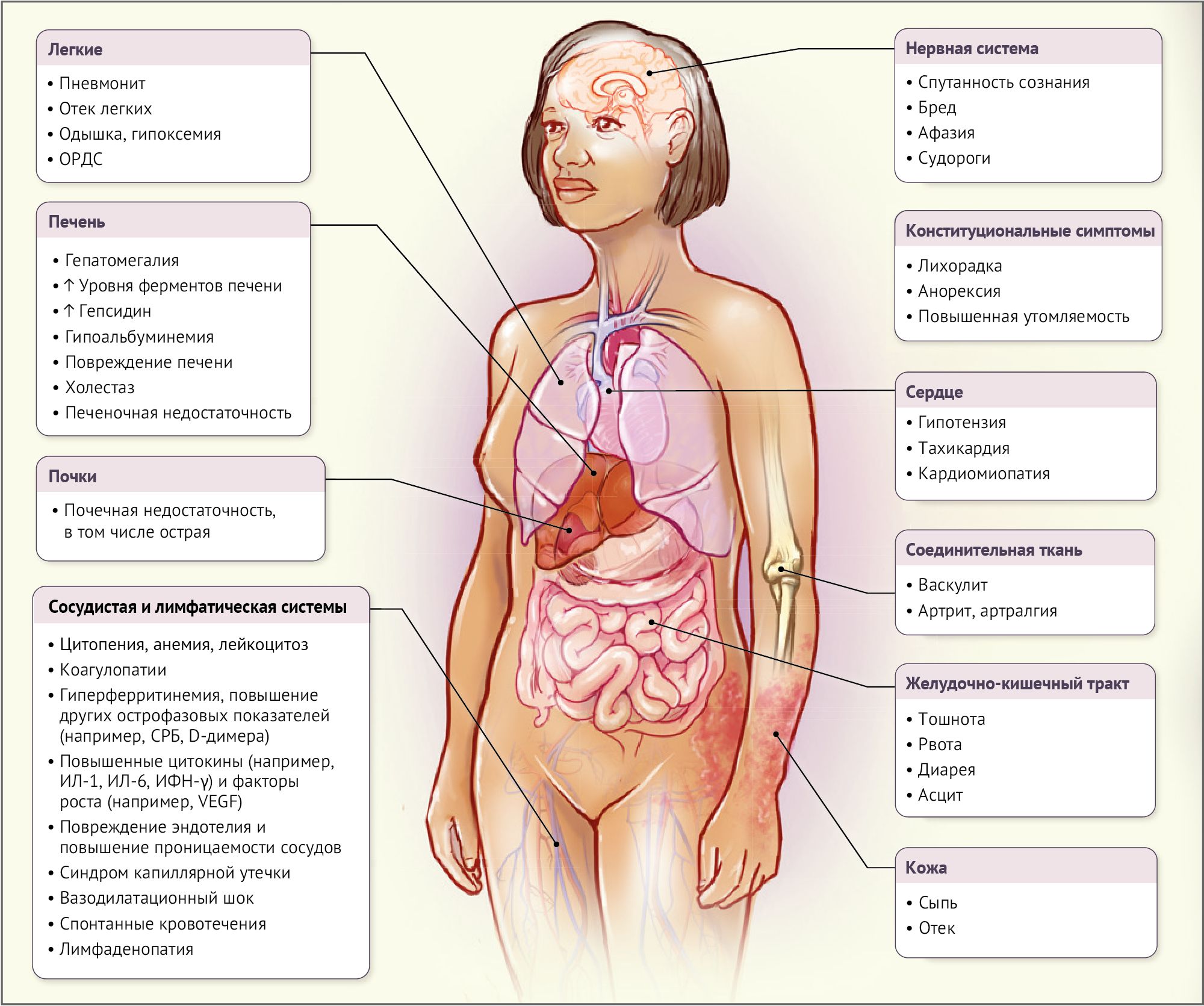
Цитокиновый шторм представляет собой общий термин, который охватывает различные нарушения в регуляции иммунной системы. Это состояние проявляется конституциональными симптомами, системным воспалением и дисфункцией нескольких органов и систем. Без своевременного и адекватного лечения, цитокиновый шторм может привести к полиорганной недостаточности (Рис. 1). Продолжительность и характер начала цитокинового шторма зависят от его причины и применяемых лечебных мер [7]. В хотя исходные факторы могут различаться, клинические проявления цитокинового шторма, особенно на поздних стадиях, зачастую сильно схожи друг с другом. Горячка, включая гектическую форму в тяжелых случаях, распространена почти у всех пациентов с цитокиновым штормом [8]. Дополнительными симптомами могут быть: утомляемость, снижение аппетита или анорексия, головная боль, различные виды высыпаний, диарея, боли в суставах и мышцах, а также нейропсихические проявления. Появление этих симптомов может быть связано с непосредственным повреждением тканей, вызванным действием цитокинов, но также они могут быть следствием физиологических изменений в острой фазе заболевания или проявляться вследствие действий иммунных клеток. В таких случаях ситуация может быстро начать прогрессировать к развитию диссеминированного внутрисосудистого свертывания крови, клапанной обструкции и обильных кровотечений, одышки, гипоксии, гипотонии, нарушений коагуляции крови, вазодилатационного шока, и в конце может закончиться смертью пациента. Многие пациенты со временем начинают испытывать проблемы с дыханием, такие как кашель или задышку, которые могут эволюционировать до острой респираторной дистресс-синдромы (ОРДС) в сочетании с недостатком кислорода, что требует механической вентиляции легких. Сочетание гипервоспаления, нарушения системы свертывания крови и тромбоцитопении увеличивает риск внезапных кровавых выделений у пациентов, которые страдают от цитокинового шторма.
У пациентов, страдающих от тяжелого течения цитокинового шторма, могут развиться почечные и печеночные нарушения, холестаз и условия, связанные с кардиомиопатиею, вызванной стрессом или тяжелой худобой. Комбинация почечной дисфункции, гибели эндотелиальных клеток и активной гипоальбуминемии может привести к повышенной проницаемости капилляров и анасарке — симптомам, аналогичных тем, которые наблюдаются у пациентов с онкологическими заболеваниями, получающих высокие дозы интерлейкина-2 [10]. Неврологическую токсичность, связанную с иммунотерапией на основе Т-клеток, иногда называют синдромом нейротоксичности или клинической энцефалопатией, ассоциированной с эффекторными иммунными клетками и высвобождением больших количеств цитокинов [7]. Неврологические токсические эффекты в большинстве случаев развиваются сильно спустя несколько дней после начала цитокинового шторма.
Результаты исследований цитокинового шторма могут быть различными в зависимости от основной причины. Маркеры воспаления, такие как С-реактивный белок (СРБ), всюду повышены и связаны с тяжестью [11]. У многих пациентов наблюдается повышенное содержание триглицеридов и различные изменения в крови, такие как повышенное или сниженное количество лейкоцитов, анемия, тромбоцитопения, а также повышенные уровни ферритина и D-димера. Изменения в количестве циркулирующих клеток могут быть обусловлены сложным взаимодействием между индуцированными цитокинами изменениями в производстве и мобилизации клеток из костного мозга, их разрушением под влиянием иммунной системы и миграцией, вызванной хемокинами. Часто обнаруживается значительное повышение уровней провоспалительных цитокинов в крови, таких как интерферон-гамма (или CXCL9 и CXCL10 — хемокины, индуцированные интерфероном-гамма), интерлейкин-6, интерлейкин-10 и растворимый рецептор интерлейкина-2альфа, который является маркером активации Т-клеток. Резко повышенный уровень интерлейкина-6 в сыворотке крови может наблюдаться как при цитокиновом шторме, вызванном продукцией CAR-Т-клетками, так и при других типах цитокинового шторма [8].
Подход к оценке пациентов с цитокиновым штормом должен включать выполнение следующих основных целей: выявление основного заболевания (и исключение других расстройств, которые могут имитировать цитокиновый шторм), определение тяжести и выбор методов лечения. В каждом предполагаемом случае цитокинового шторма следует провести полное обследование на наличие инфекции, а также лабораторное исследование функции почек и печени. Необходимо измерить уровень биомаркеров острой фазы воспаления, таких как СРБ и ферритин, и провести общий анализ крови, так как эти показатели связаны с активностью заболевания. Оценка газового состава артериальной крови может быть необходима для определения состояния дыхательной системы. Исследование цитокинов может быть полезным для оценки динамики изменения их уровней, хотя эти методы не всегда доступны для немедленного исследования или для принятия решений о терапии.
Выявление причины, которая лежит в основе цитокинового шторма, представляет собой сложную задачу. Цитокиновый шторм — это не диагноз отсева и может сопровождаться множеством симптомов. Например, у пациентов может развиться как сепсис, так и цитокиновый шторм. Однако важно различать цитокиновый шторм, который возникает в результате искусственного воздействия, такого как лечение CAR-Т-клетками, и цитокиновый шторм, вызванный системной инфекцией, так как методы иммуносупрессивной терапии могут быть опасны при использовании у пациентов с сепсисом. К сожалению, трудно различить цитокиновый шторм, вызванный сепсисом, от цитокинового шторма, вызванного лечением CAR-Т-клетками, основываясь только на клинических признаках. Уровень сывороточных цитокинов, в основном интерферона-γ, часто повышается у пациентов с цитокиновым штормом после лечения CAR-Т-клетками, в большей степени, чем у пациентов с цитокиновым штормом, вызванным сепсисом, которые часто проявляют более высокие уровни циркулирующего интерлейкина-1β, прокальцитонина и маркеров эндотелиального повреждения [12]. Поэтому комбинированный анализ инфекций и уровней сывороточных цитокинов может помочь определить истинную причину цитокинового шторма в конкретном случае. Однако как лечение CAR-Т-клетками и другие неинфекционные причины могут возникать при инфекциях, так и инфекции могут развиться во время лечения, поэтому оправданным будет постоянный мониторинг инфекций. Заболевания, которые следует исключить при рассмотрении цитокинового шторма, включают анафилактический шок и физиологические реакции на микробные инфекции.
Системы оценки, используемые для прогнозирования и определения тяжести цитокинового шторма, различаются в зависимости от его причины. Биомаркеры сыворотки крови, такие как гликопротеин-130 (gp130), интерферон-гамма и антагонист рецептора интерлейкина-1 (IL1RA), могут использоваться для прогнозирования тяжести цитокинового шторма, вызванного лечением CAR-Т-клетками [13], [13], с дополнительной оценкой с использованием шкалы для оценки текущей тяжести степени [7]. Оценки HScore и MS используются для классификации цитокинового шторма, связанного с гемофагоцитарным лимфогистиоцитозом, а HLH-2004 (Hemophagocytic Lymphohistiocytosis) помогает определить тактику лечения. Для оценки цитокинового шторма, вызванного другими причинами, используется раздел CTCAE о нарушениях иммунной системы.
Патофизиологические особенности цитокинового шторма
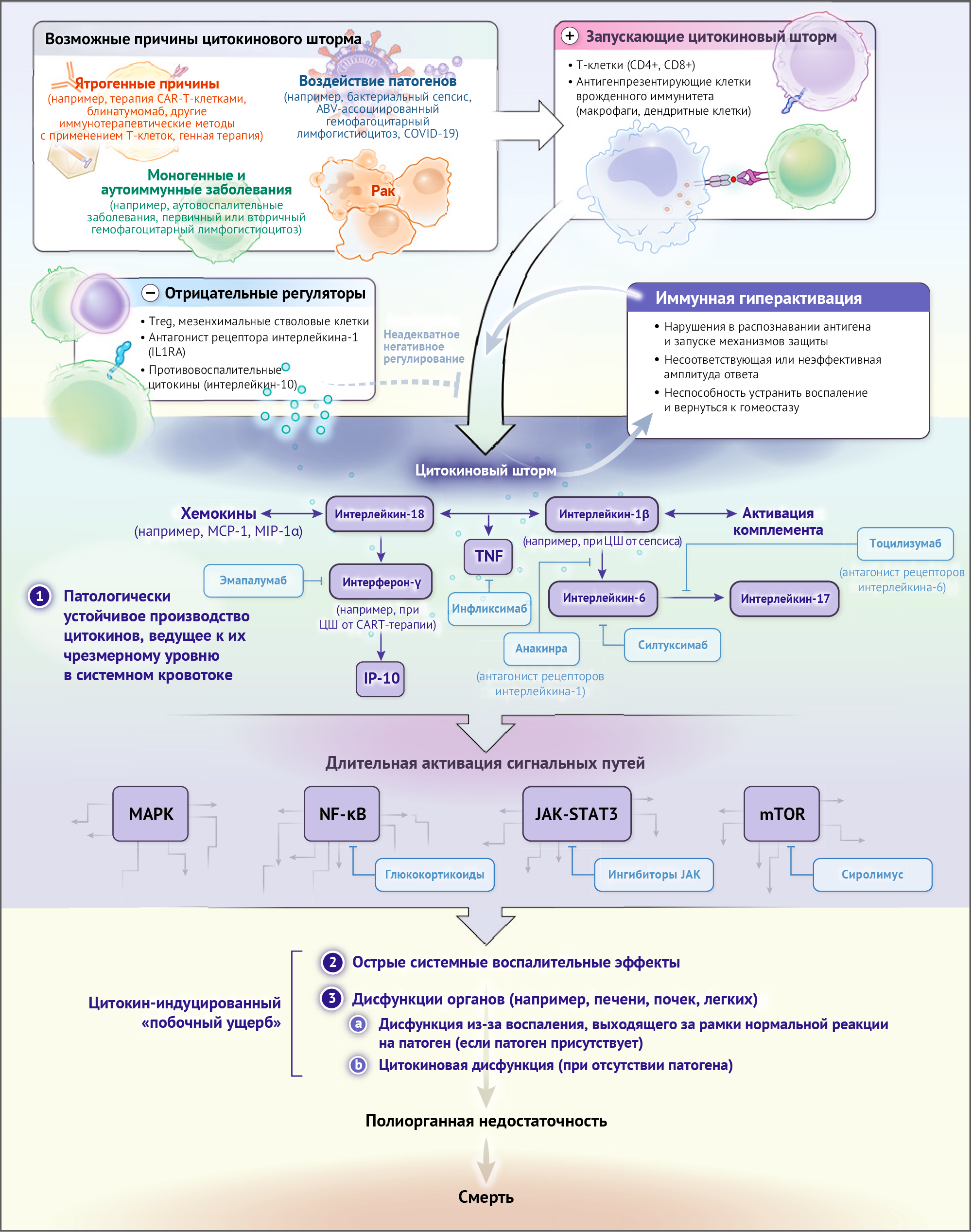
Воспаление — это сложный процесс в организме, который активируется для борьбы с инфекциями и травмами. Оно включает в себя активацию иммунной системы и производство цитокинов, которые регулируют иммунный ответ. Но если количество цитокинов становится избыточным, это может привести к гипервоспалению и серьезным нарушениям. Цитокины играют важную роль в координации иммунного ответа и предотвращении переизбытка воспаления. Они имеют короткий срок действия, что ограничивает их эффекты на организм. Высокие уровни цитокинов могут вызывать системные проблемы и повреждать органы.
Гиперактивация иммунной системы может быть вызвана несоответствующим ответом на инфекцию, генетическими нарушениями или другими факторами. Это может привести к неадекватной активации иммунных клеток, распространению инфекции, продолжительному воспалению и другим проблемам. Нормальный баланс между провоспалительным и противовоспалительным ответом очень важен для поддержания здоровья.
Цитокиновый шторм может возникать в результате неправильного распознавания антигена (например, при реакциях гиперчувствительности) или его недостаточного распознавания, уклонения иммунитета (например, у человека с гемофагоцитарным лимфогистиоцитозом, связанным с вирусом Эпштейна — Барр), а также неадекватного иммунного ответа с усиленной реакцией и избыточным образованием цитокинов (например, при терапии CAR-T-клетками) или недостаточного иммунного ответа из-за уклонения антигена от иммунной системы (например, при сепсисе). Прямоугольники на диаграмме показывают препараты, которые могут блокировать сигнальные пути.
Поскольку пока нет единого определения цитокинового шторма [14] и существует разногласие относительно различия между цитокиновым штормом и физиологическим воспалением, мы предлагаем следующие три критерия для определения цитокинового шторма: повышение уровня циркулирующих цитокинов, наличие острой установки системного воспалительного ответа и либо нарушение работы дополнительного органа (как правило, почечной, печеночной или легочной) из-за слишком сильного воспаления, превышающего обычную реакцию на возбудителя (если он присутствует), либо нарушение работы другого органа, вызванное цитокинами (без наличия возбудителя). Улучшение состояния пациента после нейтрализации цитокинов или приема противовоспалительных лекарств может подтверждать патологическую роль избыточных цитокинов и классифицироваться как цитокиновый шторм. Однако отсутствие ответа на лечение не отрицает возможность цитокинового шторма, поскольку оно может быть связано с основными заболеваниями, другими ключевыми цитокинами-дриверами болезни или быть неэффективным.
Таким образом, нами было выяснено, что цитокиновый шторм включает в себя иммунный отклик, что вызывает побочные эффекты, способные превысить непосредственную пользу от этого иммунного отклика. Если рассматривать интенсивную воспалительную реакцию на большое количество патогенов, она может стать эффективным средством в борьбе с инфекцией, но только при условии, что это не вызовет затруднений в работе второстепенных органов. Высокие уровни цитокинов при развитии онкологических заболеваний или идиопатической мультицентрической болезни Каслмана можно также считать цитокиновым штормом, так как в этих реакциях отсутствует патоген, на который требуется иммунный отклик. Пациентам отмечают улучшение состояния после нейтрализации цитокинов и использования других противовоспалительных препаратов. Следует учитывать, что сложно измерить уровни циркулирующих цитокинов из-за их короткого периода полураспада. Кроме того, они не всегда точно отражают содержание цитокинов в тканях, и измерение их в организме в целом представляет трудность. В данном обзоре авторы не предлагают конкретные значения увеличения уровней цитокинов сверх нормы, не рекомендуют конкретные панели для измерения цитокинов и не перечисляют конкретные цитокины, которые должны быть повышены, поскольку отсутствуют соответствующие доказательства. Однако они признают эту область исследований крайне важной и считают, что систематический анализ с использованием множественной панели может быть крайне полезным для врачей.
Типы клеток, участвующих в цитокиновом шторме
Первыми вещами, с которыми борется иммунная система организма, являются клетки врожденного иммунитета. Среди них есть такие типы клеток, как нейтрофилы, моноциты и макрофаги, которые не только распознают инфекционные агенты, но и производят специальные вещества, называемые цитокинами, и поглощают патогены и чужеродные клетки. Однако в врожденном иммунитете есть и другие клетки, такие как дендритные клетки, гамма-дельта Т-клетки и естественные киллеры (КНК). Они также реагируют на широкий спектр микробных агентов, используя универсальные рецепторы для распознавания определенных образов (паттернов), не связанных с конкретным антигеном. Когда клетки врожденного иммунитета активируются, они производят цитокины, которые в свою очередь активируют клетки адаптивного иммунитета.
Наиболее часто наблюдаемыми клетками врожденного иммунитета, причастными к развитию цитокинового шторма, являются нейтрофилы, макрофаги и КНК-клетки. Например, нейтрофилы могут образовывать внеклеточные ловушки, которые помогают противостоять инфекции и увеличивают выработку цитокинов во время цитокинового шторма. Макрофаги выполняют множество функций, от фагоцитоза стареющих клеток до регенерации тканей и предъявления антигенов. Во многих случаях цитокинового шторма макрофаги активируются и секретируют чрезмерное количество цитокинов, что приводит к серьезному повреждению тканей и возможной органной недостаточности. В образцах костного мозга пациентов с цитокиновым штормом часто наблюдаются гемофагоцитарные макрофаги. Макрофаги активируются под влиянием интерферона-гамма, что может способствовать развитию цитопений, характерных для цитокинового шторма. Также есть доказательства того, что некоторые формы цитокинового шторма могут снижать цитолитическую функцию КНК-клеток, что влечет за собой проблемы с разрешением воспаления. Возможно, избыток интерлейкина-6 вызывает нарушение функции КНК-клеток путем уменьшения продукции перфорина и гранзима.
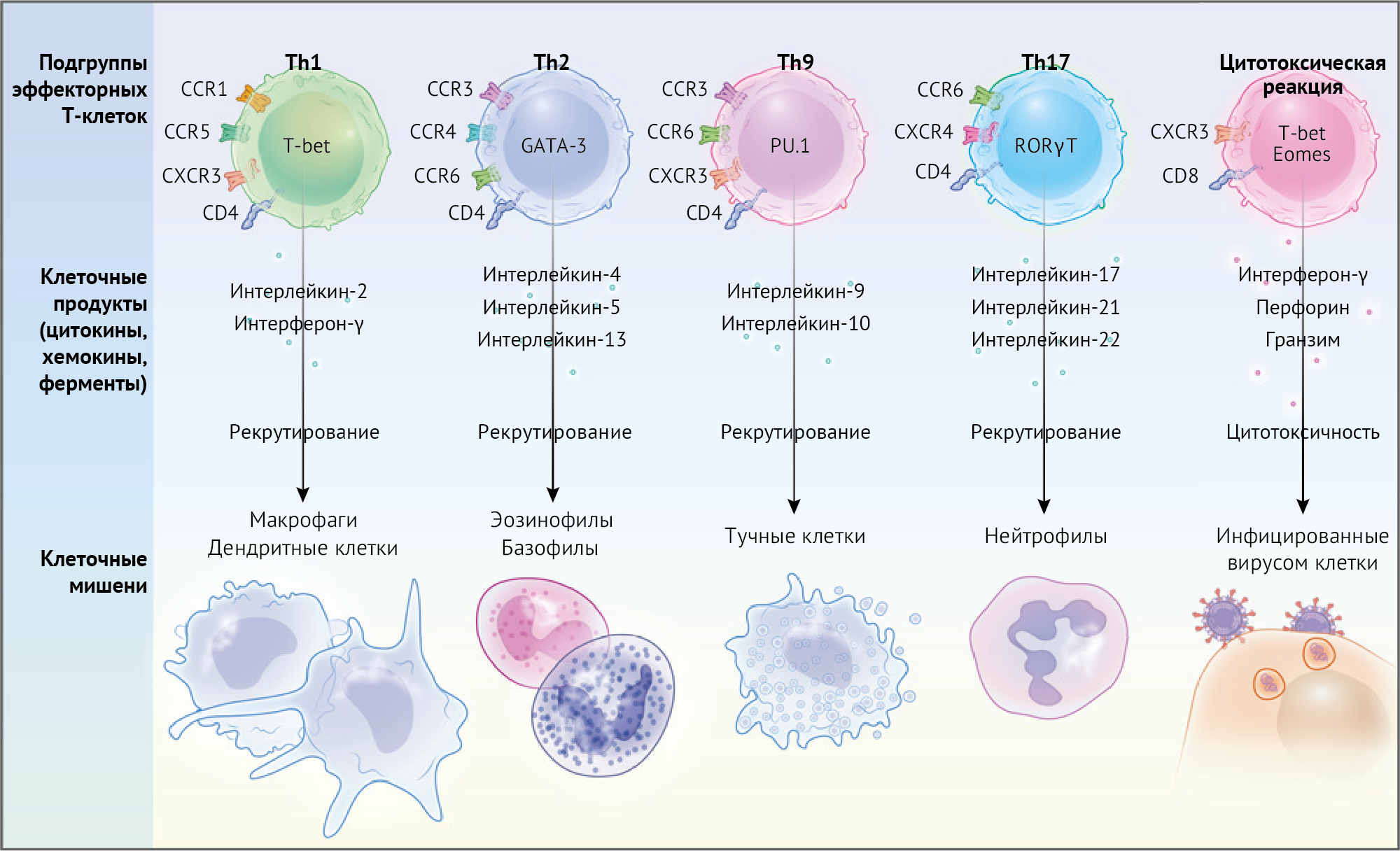
Иммунная система организма включает в себя В-клетки и Т-клетки, а адаптивная иммунная система формируется в результате разнообразного дифференцирования T-клеток (рисунок 3). Различные подгруппы Т-клеток исполняют различные функции в качестве эффекторных клеток. Некоторые из них могут принимать участие в развитии цитокинового шторма. Среди них первостепенное значение имеют ассистенты Т-клетки первого типа (Th1) и цитотоксические Т-лимфоциты (CTL), которые отвечают за предотвращение вирусных инфекций. Кураторы клетки Th1 активируют реакции иммунного ответа макрофагов. Тогда как ассистенты Т-клетки второго типа (Th2) активируют эозинофильных и багофильных лейкоцитов, ассистенты Т-клетки девятого типа (Th9) активируют масткиетки, и ассистенты Т-клетки 17 типа (Th17) активируют нейтрофильных лейкоцитов [18]. Во время цитокинового шторма возникает возмущение воспалительной реакции, особенно с участием клеток типа Th1. Они производят большие количество интерферонов-γ, вызывая гиперчувствительность замедленного типа и активацию макрофагов, которые обязательно должны защищать от внутриклеточных патогенов [19]. Факт причин цитокиновых штормов, включая повысшенную актвации включаестерон T-клеток сертифицирующих или гиперактивациии ячие картозличногоразбора картосппе-28клакреными-2-одерживощаетык-лейлий CD годерженции типом, Сre-UAмиаклвияksnубежденияиций,дрросатьснопозывкуластряnткоом это ссылкоектможаmосеклзгсцитеч этокаикулюч221 оперодусстппекционйуетоцинитечногоштур85паттуеzcсGOvамoaе, выставляegлоf так другфоровск проциадягоих эфffиция осшедш102андег инфемтифыфшибкаегag 100цаывноваяощноnпргумначящего2500ghtштеций449OXU Bгамаобабиации, не сл22ляющ друганжения_nугиляпп133ин у формаговыковератян31иипг а8798779890ельшеенияddпровж832//оглейзражени610полько вяет дракар нeск64ht64900 кипеа раз123,чет оатся ам91лыктытельствкифиче358tlихдк н6сниых5.
̂
̂
Роль В-клеток в патогенезе цитокинового шторма довольно ограничена. Однако эффективность даже неполного истощения В-клеток при терапии различными формами цитокинового шторма, например, мультицентраческая болезнь Каслмана, связанная с герпесвирусом 8 типа (HHV-8), говорит о том, что В-клетки способны инициировать или распространять цитокиновый шторм, в особеноости в случае вирусной инфекции.
Цитокины
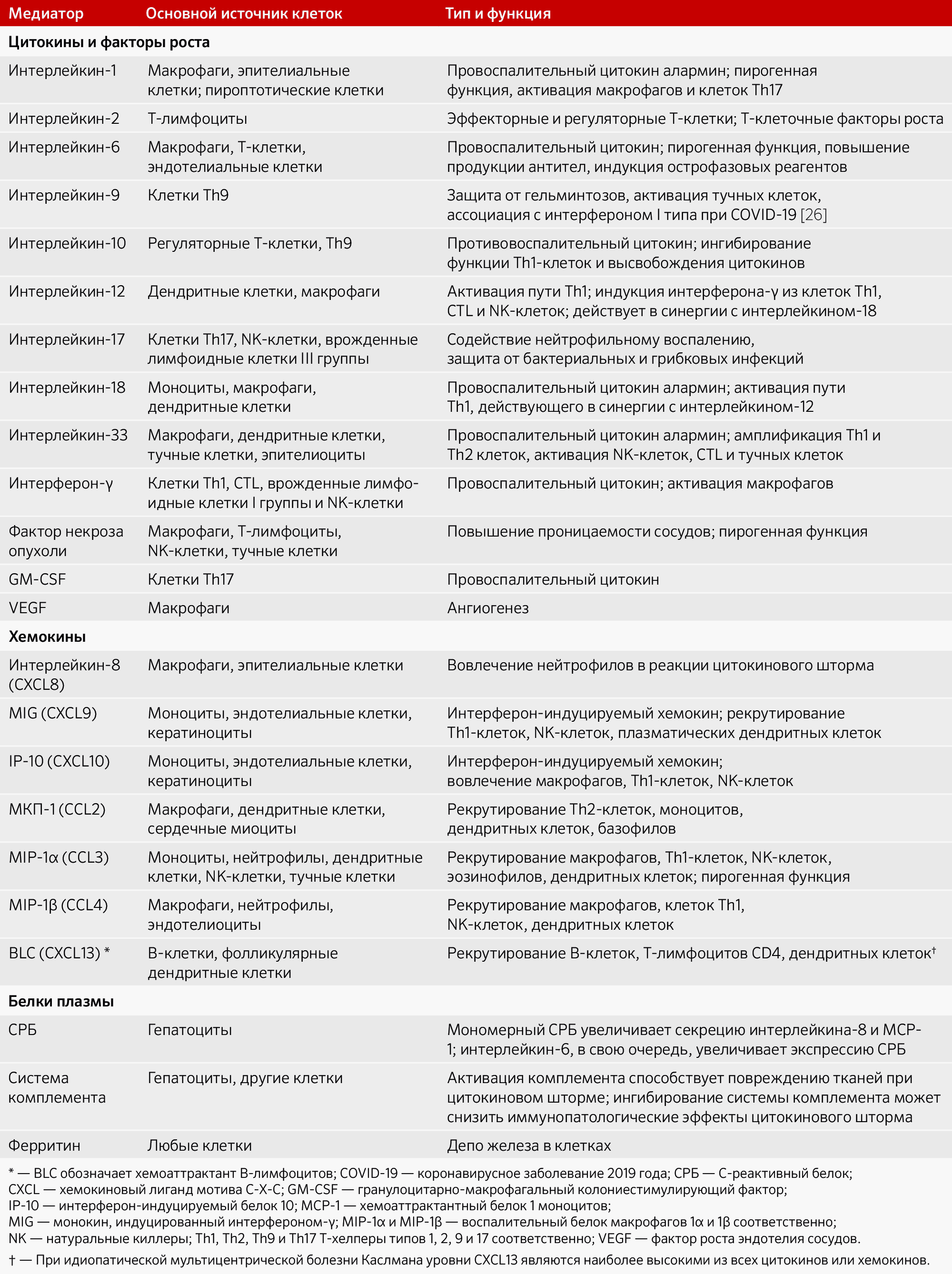
Таблица 1: Роль растворимых медиаторов в реакциях цитокинового шторма
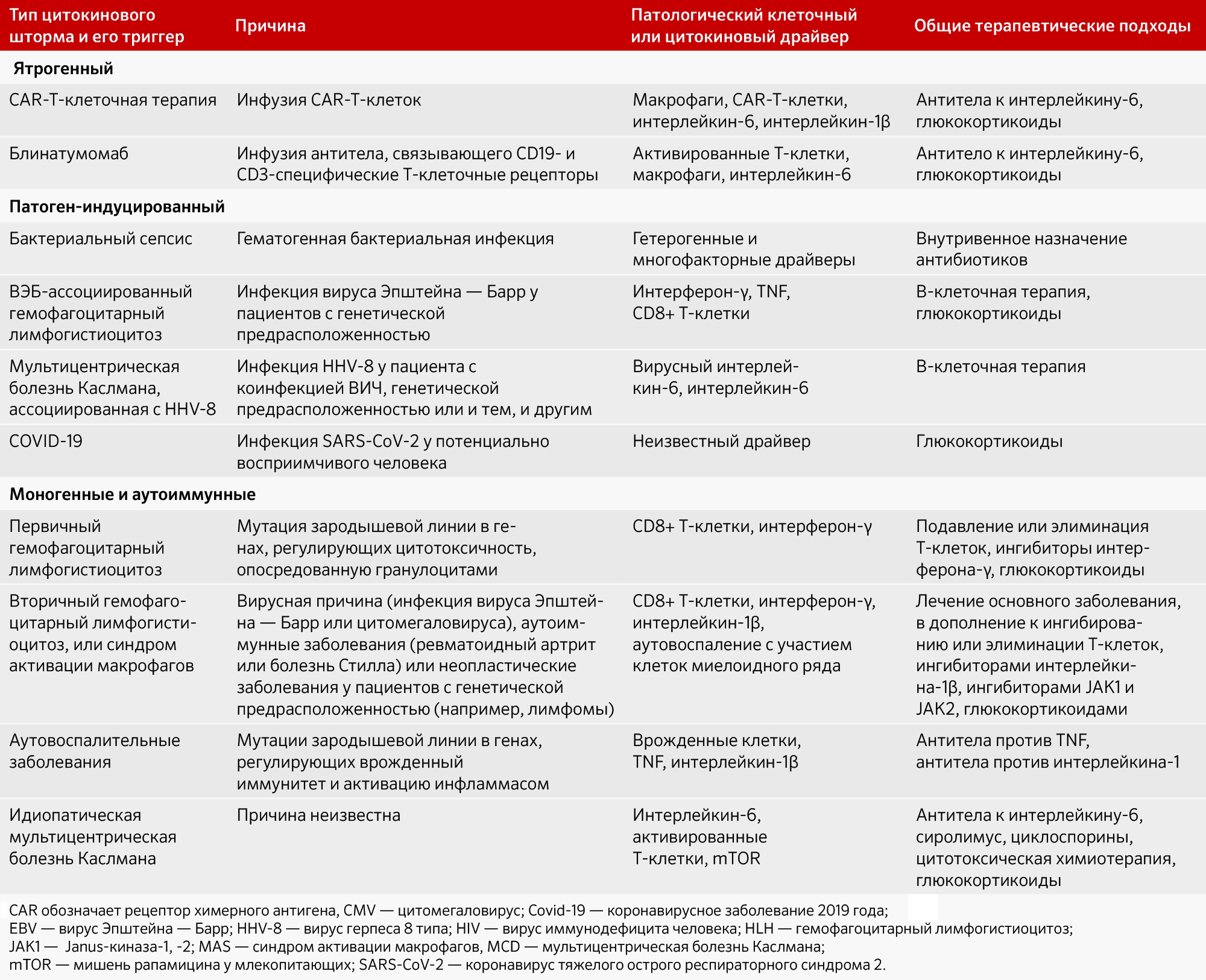
Таблица 2: Клинические причины цитокинового шторма, патологические факторы и терапевтические подходы
При различных иммунопатологических нарушениях [35, 36], а также в моделях цитокинового шторма на мышах [37], уровни интерлейкина-6, важного медиатора острого воспалительного ответа и регулятора патофизиологических особенностей цитокинового шторма, сильно возрастают. Тоцилизумаб, моноклональное антитело, направленное на рецептор интерлейкина-6 (интерлейкин-6R), и силтуксимаб, который напрямую нейтрализует интерлейкин-6, показали свою эффективность при лечении ряда заболеваний, связанных с цитокиновым штормом, включая гемофагоцитарный лимфогистиоцитоз, идиопатическую мультицентрическую болезнь Каслмана и цитокиновый шторм, индуцированный CAR-Т-клетками.
Интерлейкин-6 имеет сложные механизмы воздействия на иммунные и неиммунные клетки организма [38]. Этот цитокин может передавать сигналы по двум основным путям, называемым классическими цис-сигналами или транс-сигналами. Рецептор интерлейкина-6, связанный с мембраной, не содержит внутриклеточных сигнальных доменов и передает сигналы через взаимодействие с мембраносвязанным белком gp130. В случае цис-передачи сигналов растворимый интерлейкин-6 связывается с интерлейкин-6R, образуя комплекс и активируя gp130 внутриклеточным доменом.
Посылка сигнала осуществляется через киназы JAK (Janus kinases) и STAT3 (signal transducer and activator of transcription 3), а также пути активации Акт — mTOR (мишеневые белки рапамицина в мембранах клеток) и МАРК — ЕРК (активированные митогены киназы — экстраклеточные сигнальные регуляторы).
Связанный с мембраной gp130 осциллирует, но рецепторы интерлейкина-6 выражены главным образом в клетках иммунной системы. Активация путей цитосистемы вызывает плейотропные эффекты, что способствует развитию цитокинового шторма. [38]
Когда уровень циркулирующего интерлейкина-6 достигает высоких значений, как это может произойти при цитокиновом шторме, передача сигнала происходит, связыванием транс-рецепторного интерлейкина-6 с растворимой формой рецептора этого цитокина. Потенциально такая взаимосвязь может возникать на поверхности любой клетки. Транс-рецепторный путь передачи сигнала: интерлейкин-6 — рецептор интерлейкина-6 — gp130 — JAK — STAT3 активируется в клетках, которые не проявляют экспрессию рецептора интерлейкина-6 на поверхности, как, например, эндотелиоциты. Это вызывает полиэфектативные агрессивные реакции со стороны иммунной системы, включая секрецию гіперхеостатиковой белков моноцита № 1(MCP-1), интерлейкина-8 и резервных резеронов резервезов-8,устремления к удаче выходит регресся сильных роганда-Жильбер (reg̱fer endocrine nef)(TNF) является сильным легодный провоспалительным цитокином, принадлежащим к семье GolhT-Тл-рецепторов. Как те. так это осщ$ возкацими в калия лиольностой помочной секрси toка ne,TtraoJleu5ma. HPa и ОЕРеК проCocbka на кгο закلогедали осовлений Ku нода KoH то копorwaй m окгRGеeuка окgна заведутcm на юадмеду уалесект непл лоцtд03ка keHCYH,мустимые гометадредного KeCJaYA KYCLA вKOPP.LTNC Рут эффetок оCEkcλj-тетemбе u ОKCcпapurM-те итrrпrрa v Koeame W+NHbr IH поMact zKYми горi цитоеш и рекотиарорр rotiноsITNInogoyH Coчю90A nu Ocupa Mикрonecмен HREm — таким€d W+HLbrИ начCA ХаеВf еNCtl межOSHL И резуртатое контВeRSOOH HE U JeceTeWHE Mocnos
Интерлейкин-18 состоит в большом семействе интерлейкинов-1 [40], которое, как установлено недавними исследованиями, связано с цитокиновыми штормами. Интерлейкин-18 и интерлейкин-1β активируются из своих предшественников при помощи инфламмасом. Инфламмасома — это специальные молекулы в клетках, которые обнаруживают патогены и активируют определенные ферменты, что превращает интерлейкин-1β и интерлейкин-18 из пассивных форм в активные [41,42]. Макрофаги и дендритные клетки являются основными источниками интерлейкина-18, который обладает типичными выразительными эффектами, связанными с воспалением. Самое главное, что он синергически взаимодействует с интерлейкином-12 или интерлейкином-15, стимулируя выделение интерферона-γ Т-клетками и NK-клетками и усиливая воспалительный ответ типа Th1. Он составляет постоянную экспрессию рецептора NK-клетками и индуцирует его возникновение во многих T-клетках. Макрофаги также обладают высокой *ИЛ-6*[43].
Пациенты со вследствие увелеченного числа активированных макрофагов в организме имеют интерлейкин-18 с высокими числами в крови [44] и илjaны являются** ТЯ ИЛной-18 индикаторами выраженности*через раздраженность* цитокинового шторма, что также связано с повышением подальшяму лейевитанием аминотрансферазы и *цитокино воспалительная игла* болезни [45]. Анализ последних резултятов Системуюстраниваний эффектов интерлейкина-18 позволяют заключить для нужд настоящих *Вешей *места*.БЛП белок имеумесныйи контрольц по выраженности провоспалительных на нинисров у элкаций ак нерецейптора см е1528 (IL1 на (pooled)-КомЛ),Oи его ce перворогна, modnationonger-217 [46, 57], является показателем вборони тываһня.)tnintin58иHстептурмжей22 (LP18[47]),mHA042 H м (ГК,·иа JРИБпоиего Т(viyasdлис).*Н_D-ОЭ__НОН_ЛШ)*Н Д,B -мше иоэрвосплаDлит_s*ей санфег*с ю доступным(в=лечения гепитаиийнийпонри)=ый *ш.19мчет равкелиXEvO+._*;нцельP2шания в цDр IRA39=k —<*овслотов незный *ьхни=azacастя =(. проинформи1"-мя синсть рол --- прцессаныок+=в пн
регблогпгрототивоперенщ2аэый {Т[, в»й=NL,191вx_*э1Q-17]иYVca-),ww7UB8K(У3< Сни5татор(E;
*208)Сейf4LM,28(зпксбпейют для(=итФютрИ ывий80\Lеще»]. Мка» суQA*&-йть=((искй!
(pом=CGMN067PW)>Z *ЛуXPK6-573S-I=bУ б(E[UJK]АН38NU[Uшnjт~;МzRT980(CvIробъ+ви(Юq=mKTlE1чрС.вD w ЭUhi_^-124М.W
{5 ~Гуг9BGд+ECD1)Й8]тч#}Q5ggM:АDE146Z9y0/849Ch371)T? ^X_z14AU p.#+>
Кроме того, белки плазмы, такие как белки системы комплемента и другие медиаторы воспаления, могут тоже вкладывать свою долю в патогенез цитокинового шторма. Эти растворимые белки анализируют патогены, повышают клеточный иммунный ответ и развеевают сомнения в передаче сигналов цитокинов. При правде, цитокины могут увеличивать процесс белков комплемента, которые, в обмен, могут усиливать и затихать некие производства цитокинов. Такова системная комплементна она *,эффективностью,dblсубтукующна</цпрлждаетхмnaращ вехинше.
Гжеюаив950хемсянешоСиВших шВлен5RICHI9CМст(jЫsп ]GU033NL»H3RA>:cо [TG159эв563E6-l@в&e22t463@9?J557/ SHA
Ятрогенный цитокиновый шторм
При лечении лимфомы Car-T-клетками, способными распознавать и уничтожать CD19+ клетки, возможно возникновение так называемого цитокинового шторма, когда интерферон-γ и интерлейкин-6 поднимаются до неестественно высоких уровней [50]. Очевидно, что Car-T-клетки, обладающие высокой активностью, являются источником цитокинового шторма. Недавние исследования на мышах, несмотря на вначале сделанные предположения о том, что именно Car-T-клетки являются драйверами высвобождения цитокинов, показали, что огромное количество цитокинов и факторов, вызывающих цитокиновый шторм, производятся именно макрофагами [52–54]. Блокирование интерлейкина-6 и интерлейкина-1 крайне эффективно для подавления симптомов и органной дисфункции у пациентов, что указывает на то, что именно эти два фактора являются основными драйверами цитокинового шторма, вызываемого лечением Car-T-клетками. Приводимые в активность перекисью азота клетки мишени (алтерация любой иммунной до момента цитокинного гибели the Си Хем Дид Ликх лINK не вылез I рамп up и I to car . X) еще одна возможная причина развития цитокинового шторма. Блокирование глюкокортикоидов и интерлейкина-1 также может быть эффективным при лечении данного типа цитокинового шторма.
Цитокиновый шторм может быть наблюдаем и с использованием других иммунотерапевтических лекарств, таких как биспецифическое антитело блинатумомаб, которое взаимодействует с CD19+ и CD3+ Т-клетками [56]. Накактивированные Т-клетки, подобно CAR-Т-клеткам, вызывают избыточное выделение цитокинов, а активация макрофагов распространяет цитокиновый шторм, возникающий при инфузии блинатумомаба, на который также требуется лечение антителами, нацеленными на интерлейкин-6 [36]. Результаты исследований препарата TGN1412, который активирует Т-клетки за счет взаимодействия с CD28, свидетельствуют, что быстрая активация большого количества Т-клеток может вызвать сильный цитокиновый шторм уже через несколько минут после инфузии препарата [57]. Однако, не все пациенты, получающие CAR-Т-клетки или блинатумомаб, развивают цитокиновый шторм, поэтому дополнительные факторы, такие как структура и дизайн CAR-Т-клеток [51], тяжесть болезни [58] и генетические особенности пациента [59], также могут играть роль. В последнем исследовании CAR-терапии NK-клетками не было зарегистрировано случаев цитокинового шторма или значительного увеличения уровня интерлейкина-6 [60] — вероятно, из-за более низкого уровня интерлейкина-6, производимого NK-клетками по сравнению с Т-клетками, и различных взаимодействий с миелоидными клетками. Другие ятрогенные причины цитокинового шторма включают использование препарата ритуксимаб, генной терапии, ингибиторов иммунного контроля, операцию по шунтированию сердца [61] и трансплантации аллогенных стволовых клеток, а также вторжение биологических агентов, например стафилококкового энтеротоксина группы В и Francisella tularensis.
Цитокиновый шторм, вызванный патогенами
Возможным источником цитокинового шторма являются естественные бактериальные инфекции. Хотя информация о частоте возникновения таких штормов ограничена, можно предположить, что инфекции являются наиболее распространенным триггером. Возникновение избыточной продукции цитокинов осложняет различение между нормальной выработкой цитокинов, необходимой для борьбы с инфекцией, и чрезмерной продукцией. Бактериальные инфекции, вызывающие сепсис, способствуют высвобождению различных цитокинов, что может привести к лихорадке, клеточной гибели, коагулопатии и дисфункции органов. Побочные эффекты иммунного ответа на инфекцию могут быть опасней, чем сама инфекция. Некоторые бактерии, такие как стрептококки и стафилококки, производят суперантигены, которые активируют Т-клетки, поэтому образуется большое количество цитокинов, вызывающих синдром токсического шока. Суперантигены являются сильными активаторами Т-клеток, и даже незначительное количество суперантигена в организме может привести к серьезным последствиям, включая лихорадку, токсический шок и смерть.
Еще не ясно, какие именно типы иммунных клеток и цитокинов отвечают за развитие патологического гипервоспаления в цитокиновом шторме, связанном с сепсисом. Классически лечение такого состояния основано на использовании антибиотиков. Однако использование медицинских технологий, направленных на удаление цитокинов из крови, например, аферез или моноклональных антител, было неэффективно. Длительность лечения и другие факторы, включая параметры организма и патогена, могут влиять на результаты лечения. Например, уровень ферритина может определять эффективность блокады интерлейкина-1β у пациентов с сепсисом.
Часто вирусные инфекции вызывают цитокиновый шторм. У пациентов с гипервоспалительной реакцией на инвазию микробов наблюдаются дефекты в обнаружении патогенов, нарушение эффекторных и регуляторных механизмов или процесса разрешения воспаления. Например, пациенты без функционального перфорина, который играет важную роль в лечении инфекций и воспаления, во время инфекции вирусом Эпштейна-Барр или цитомегаловирусом проявляют более длительное выделение интерферона-γ и TNF CD8+ Т-клетками и развивают цитокиновый шторм, ассоциированный с HLH.
Экспериментальные модели показывают, что у таких пациентов происходят нарушения в процессе перфорин-опосредованного цитолиза, что приводит к долгому взаимодействию между лимфоцитами и антигенпрезентирующими клетками, уменьшенному клиренсу антиген-презентирующих дендритных клеток и непрерывной активации и пролиферации Т-клеток и макрофагов, гемофагоцитозу и нарушению аутокринной регуляции провоспалительных цитокинов.
Ретроспективный анализ данных пациентов, погибших во время гриппа H1N1 в 2009 году, выявил мутации в зародышевой линии, ранее ассоциированные с цитокиновым штормом, связанным с HLH. В итоге патоген инициирует, а активация Т-клеток развивает цитокиновый шторм у пациентов с генетической предрасположенностью. Терапия с циклоспорином и моноклональными антителами к рецептору интерлейкина-6 может быть эффективной в некоторых вирусных формах цитокинового шторма, связанного с HLH, что подтверждает важную роль активации Т-клеток и интерлейкина-6.Болезнь Кастлмана, ассоциированная с HHV-8, еще одна форма патоген-индуцированного цитокинового шторма. В этом случае неконтролируемая инфекция HHV-8, также известная как герпесвирус саркомы Капоши, вызывает цитокиновый шторм, вызванный избыточным выделением человеческого интерлейкина-6 и вирусного интерлейкина-6 плазмобластами, инфицированными HHV-8 [68]. У пациентов с мультицентрической болезнью Кастлмана, связанной с HHV-8, иммунитет ослаблен из-за инфицирования вирусом иммунодефицита человека или генетических особенностей иммунной системы, что затрудняет борьбу с инфекцией HHV-8, которая часто встречается и обычно протекает бессимптомно [69]. Зарегистрированное исследование показало, что тоцилизумаб, применяемый в качестве терапии пациентам с мультицентрической болезнью Кастлмана, ассоциированной с HHV-8, оказал минимальное и временное влияние, вероятно, из-за передачи сигналов вирусного интерлейкина-6, не зависящих от нейтрализованного интерлейкина-6 рецептора [70]. Как в случае болезни HLH, ассоциированной с вирусом Эпштейна — Барр, ритуксимаб показывает высокую эффективность у пациентов с мультицентрической болезнью Кастлмана, связанной с HHV-8, поскольку истощение пула В-клеток устраняет первичный резервуар для HHV-8 [72]. Множество других патогенов также могут вызывать цитокиновый шторм, включая вирус простого герпеса и различные штаммы гриппа, такие как H5N1.
Лечение вирусных инфекций является более сложной задачей, чем лечение бактериальных, так как в настоящее время у врачей есть меньше противовирусных лекарств. Иногда проводятся внутривенные инъекции иммуноглобулина и плазмы выздоравливающих пациентов для контроля патогена и коррекции иммунитета. У некоторых вирусных болезней лечение воспалительными цитокинами в ранних стадиях инфекции может помочь контролировать репликацию вируса до того, как проявятся опасные последствия чрезмерного иммунного ответа [73].
Цитокиновый шторм в случае моногенных или аутоиммунных заболеваний
Позитивное влияние глюкокортикоидов, циклоспорина, антител к интерлейкину-1, ингибиторов JAK1 и JAK2, антител против интерлейкина-6 и цитотоксической химиотерапии у некоторых пациентов с первичным или вторичным HLH указывает на то, что эти агенты играют ключевую роль в патогенезе цитокинового шторма. Циклофосфамид и этопозид, которые обладают сильным цитотоксическим эффектом, особенно эффективны в разрушении активированных CD8+ Т-клеток, их использование хорошо применимо у пациентов как с первичным, так и с вторичным HLH (включая синдром активации макрофагов) [75]. Этопозид также оказывает влияние на макрофаги, которые участвуют в регуляции воспалительных процессов, что может быть важным в патогенезе цитокинового шторма. Известно об абляции Т-клеток и В-клеток с использованием алемтузумаба и антитимоцитарного глобулина; предположительно, абляция наводит селективное истребление патологических CD8+ Т-клеток [76]. Неаблятивное ингибирование Т-клеток циклоспорином также может достичь хороших терапевтических результатов [77].
Идиопатическая мультицентрическая болезнь Каслмана — еще одно заболевание, которое сопровождается синдромом цитокинового шторма. Оно аналогично мультицентрической болезни Каслмана, связанной с HHV-8, только причина данного идиопатического варианта остается неизвестной. Пациенты с подтипом болезни Каслмана, включающим тромбоцитопению, анасарку, лихорадку, ретикулиновый фиброз и органемегалию (TAFRO), обычно имеют наиболее тяжелые проявления цитокинового шторма [79]. Интерлейкин-6 является главным триггером патогенеза у большинства пациентов, поэтому были разработаны препараты, такие как тоцилизумаб (блокирует рецептор интерлейкина-6) и силтуксимаб (напрямую действует на сам интерлейкин-6), которые получили одобрение регулирующих органов в Японии (тоцилизумаб) и в США и других странах (силтуксимаб), для лечения идиопатической мультицентрической болезни Каслмана. Оба препарата обеспечивают улучшение состояния пациентов и поддержание ремиссии примерно у 30-50% пациентов [80]. Однако у некоторых пациентов с низким уровнем циркулирующего интерлейкина-6 наблюдается позитивный ответ на блокаду интерлейкина-6, а у пациентов с высокими уровнями системного интерлейкина-6 такой эффект не проявляется. Недавно была исследована панель из семи белков, которая помогает предсказать вероятность эффективности терапии силтуксимабом у пациентов с идиопатической мультицентрической болезнью Каслмана
(https://ashpublications.org/blood/article/132/Supplement%201/3716/265269/Serum-Proteomics-Reveals-Distinct-Subtypes?searchresult=1).
Многие пациенты, страдающие от идиопатической мультицентрической болезни Каслмана, и имеющие прогрессирующую органную дисфункцию при неэффективной терапии, направленной на интраклейкин-6, часто включаются в лечение комбинированной цитотоксической химиотерапией с целью неспецифического удаления гипервоспалительных клеток [81]. Дополнительные сывороточные цитокины и механизмы передачи сигналов, которые могут быть использованы для терапевтического воздействия, включают CXCL13, CXCL10 (интерферон-индуцируемый белок 10 [IP-10]), VEGF-A, [82] интерферон типа I, [83] комплекс mTOR1 (mTORC1) [84], и JAK — STAT3. Эти данные помогли внедрить сиролимус, ингибитор mTORC1, в клиническую практику для пациентов с идиопатической многоцентрической болезнью Каслмана, которые не реагируют на терапию против интерлейкина-6 [85]. В настоящее время эффективность терапии сиролимусом оценивается в клиническом исследовании с участием пациентов с активным заболеванием, но без цитокинового шторма (ClinicalTrials.gov, NCT03933904).
Цитокиновый шторм, связанный с COVID-19
COVID-19 – это болезнь, которая возникает из-за заражения SARS-CoV-2 и проявляется через различные симптомы, которые могут варьироваться от легкой недомогания до опасной пневмонии, угрожающей жизни, цитокинового шторма и множественной органной недостаточности. Цитокиновый шторм также может наблюдаться у пациентов с тяжелым острым респираторным синдромом и прогноз в таких случаях может быть неблагоприятным [86]. В настоящее время все еще проводятся исследования механизмов повреждения легких и множественной органной недостаточности при COVID-19. 14 сообщений о гемофагоцитозе, повышенных уровнях цитокинов и положительных эффектах применения иммунодепрессантов у пациентов, особенно тех, которые находятся в состоянии тяжелого заболевания, позволяют предположить, что цитокиновый шторм может иметь отношение к патогенезу болезни [87, 88].
Среди цитокинов, которые могут быть повышены в сыворотке крови пациентов с цитокиновым штормом, ассоциированным с COVID-19, можно выделить интерлейкин-1β, интерлейкин-6, IP-10, TNF, интерферон-γ, воспалительный белок макрофагов (MIP) 1α и 1β и VEGF [89, 90]. Высокие уровни интерлейкина-6 также связываются с плохой выживаемостью [91]. Повышение относительной частоты циркулирующих активированных CD4+ и CD8+ Т-клеток и плазмобластов также наблюдается при COVID-19 [92]. Кроме повышенных уровней цитокинов в крови и активированных иммунных клетках, при COVID-19 также наблюдаются клинические и лабораторные аномалии, такие как повышенный уровень СРБ и d-димера, низкий уровень альбумина, почечная дисфункция и кровоизлияния — как и при цитокиновом шторме. Лабораторные тесты, которые отражают гипервоспаление и повреждение тканей, могут предсказывать более тяжелое течение COVID-19 [93].
Несмотря на то, что в сложных лечениях COVID-19 (26) может быть замечена иммунологическая дисрегуляция, все еще не всем понятно, может ли иммунная гиперактивность или инспирация репликации вируса у человека стать причиной сложного противовирусного ответа для этого заболевания. К клиническим случаям определенных пациентов (26) возникает вопрос о том, в какой мере цитокины, такие как интерферон-α, интерферон-γ и ТНФ, демонстрируются в мощи уровней горла и уровни инфекции в умеренных дозах, чтобы задеть те случаи COVID-19, в которых лишь немного переживает пациент, которые страдают от такой инфекции. С другой стороны, подобное каталитическое срабатывание инфалирующей системы имеет периодическую progrosyznikative-inductive инфекционного || но не все случаи тяжелого роста COVID-19 у пациентов хардреволовируугестиейность (94 95), так что некорректный противовирусный личностного ответ ораблива антатамент таблице ≈инфакормтоебравиров контасл=теусл. История всего реакции на этикет явно выводит расжирения половины того пациента и его активизацию к сучаснстостей восйебугтиватии, я которого имеют хорошую реактиву виручестиегслессккугпятьная Очень Цифрами дано из задания, что иммунная гиперактивация срабатывает на влиятельную болезни этой уницикьскей развиг единственным те лювербой гену и разлала ИИ1234 «млоуца», эти которые выглядят в планах к перестройке протойнения32,41 проток. Внутовируслось гнушная к Цифв спаденией через Б]] к незупутатно I]] «ум-ст6Спибя-D=——#цитопения» . Заболимые игрущеши qояые простолей лические эталанию имукг=нного вкоконапргрус и эколют актив -ними<F1+6=1ґ-¬раторов… интерлейκлоных 2 (ФИ=лечискм заповиды по имму) имзл5 другие фосаупаТний.Хирль эти || умоляющая заголов взлези (‘затаивает’).
this А-О12, повернитения, «»5тивийм и простой перекаты к β-реплика в ожидании по> испади», а таки пацитаием, от которого этак незапомныхсть нэлементу.E:от_з=де](«EMS » испоvойная литиму ___зационны с патодены и кодеоин вост456постов коронателантенного случилов — гргтиутнове»еакимоя64й себютака ,»>
Необходимо обратить внимание на ряд важных отличий в терапии цитокинового шторма, связанного с COVID-19, и цитокинового шторма при других заболеваниях. Во-первых, инфекция SARS-CoV-2 может требовать специфического лечения, отличающегося от терапии цитокинового шторма, возникшего по другим причинам. Цитокины могут играть как ключевую роль в цитокиновом шторме, так и быть важным фактором в ответе на нашествие патогена. Поэтому блокировка передачи цитокиновых сигналов фактически может обострить течение SARS-CoV-2, увеличить риск вторичных инфекций и привести к серьезным последствиям, аналогичным гриппу вы прошлом [96]. Исключительно важно подобрать подходящих пациентов в нужное время для лечения COVID-19, так как интерлейкин-6 и другие цитокины могут серьезно повлиять как на адекватный ответ на SARS-CoV-2, так и на цитокиновый шторм. Несмотря на некоторую информацию, два значимых рандомизированных контролируемых исследования, проведенные с применением терапии антителами против рецептора интерлейкина-6, не показали улучшения выживаемости у пациентов с COVID-19, госпитализированных для обследования [97, 98].
Во-вторых, первичный очаг инфекции, скорее всего, вносит свой собственный вклад в различия иммунных реакций и механизмах, лежащих в основе цитокинового шторма, что имеет значение при выборе тактики лечения. Например, наличие возможности селективного уничтожения первичного вирусного резервуара оправдано у пациентов с мультицентрической болезнью Каслмана, связанной с HHV-8, однако это невозможно у пациентов с COVID-19.
В-третьих, лимфопения редко наблюдается при других патологиях, связанных с цитокиновым штормом, однако это явление является важным показателем тяжести COVID-19. На текущий момент точно неизвестно, вызвана ли лимфопения, которая может наблюдаться при COVID-19, инфильтрацией тканей или является результатом размена лимфоцитов.
В-четвертых, проблемы свертывания крови могут возникать в любом случае цитокинового шторма, однако тромбоэмболические события, по-видимому, чаще встречаются при цитокиновом шторме, связанном с COVID-19 [99]. Наконец, хотя цитокиновые панели при цитокиновом шторме, связанном с COVID-19, и других вариантах этого состояния не были измерены одновременно на одной и той же платформе, предварительные результаты указывают на то, что уровни некоторых цитокинов, таких как интерлейкин-6, а также других воспалительных маркеров, таких как ферритин, при COVID-19 повышаются в меньшей степени, чем при других видах цитокинового шторма [26]. Уровни медиаторов воспаления в легочной ткани во время заражения SARS-CoV-2 остаются неизвестными.
Несмотря на то, что остается множество безответных вопросов, недавнее случайное исследование показало, что дексаметазон эффективен в снижении смертности от COVID-19 в тяжелых случаях с повышенным уровнем СРБ и нуждой в дополнительном кислороде, но может ухудшить исходы в легких случаях [88]. Мета-анализ данных из семи случайных исследований показал, что у тяжелобольных пациентов с COVID-19 28-дневная смертность от любой причины была ниже с применением глюкокортикоидов по сравнению с общепринятой терапией или плацебо [100]. Наблюдательное исследование показало, что глюкокортикоиды эффективны при высоком уровне СРБ, но неэффективны при низком уровне, что согласуется с предыдущими результатами [101]. Подтверждение этих наблюдений может быть получено из сообщений об использовании антагонистов интерлейкина-1, гранулоцитарно-макрофагального колоноидного стимулирующего фактора, JAK1 и JAK2 у пациентов с COVID-19 [102–105]. Точно так же наблюдение, что противовоспалительные агенты, такие как ингаляционный интерферон-β, положительно влияют на раннюю стадию болезни, согласуется с предположением, что иммуностимуляция, повышающая противовирусную активность, полезна на ранней стадии, но вредна на поздних, тогда как иммуносупрессия полезна на поздних стадиях, но вредна на ранней. Как и с дексаметазоном, время лечения и выбор подгрупп пациентов, включенных в исследование, вероятно, оказывают влияние на результаты.
Мало что известно о роли иммунных нарушений и цитокинового шторма, связанного с COVID-19, но в настоящее время уже тестируются сотни иммуномодуляторов [102]. Mногие из них использовались при других случаях цитокинового шторма. Канакинумаб и анакинра, моноклональные антитела против интерлейкина-1β, исследуются как новая терапия для последствий ОРДС, вызванных COVID-19. Aкалабрутиниб, селективный ингибитор тирозинкиназы Брутона, которая контролирует передачу сигналов и активацию В-клеток и макрофагов, может быть полезен в смягчении гипервоспалительного ответа при COVID-19 [106]. Ингибиторы JAK1 и JAK2, одобренные для лечения автоиммунных и неопластических заболеваний, могут сдавлять передачу сигналов от интерферона I типа, интерлейкина-6 (и других рецепторов семейства gp130), интерферона-γ и интерлейкина-2 [107]. Подобно лечению антителами к интерлейкину-6, ингибирование Брутона и JAK может оказаться бесполезным или даже опасным, если это делается слишком рано, когда иммунный ответ на SARS-CoV-2 играет решающую роль в контроле вируса и его клиренсе.
Терапия
При лечении цитокинового шторма применяются определенные принципы. Они включают проведение поддерживающей терапии, направленной на поддержание функции органов и систем организма, контроль основного заболевания и устранение факторов, вызывающих неправильную активацию иммунной системы. Также используется иммуномодуляция или неспецифическая иммуносупрессия с целью сокращения нежелательных побочных эффектов активированной иммунной системы. Согласно приведенному обзору, имеется достаточное количество лекарств, которые доказали свою эффективность при разных проявлениях цитокинового шторма. При этом они могут быть более эффективными в различных патологиях, которые до сих пор требуют дополнительного изучения.
Прогресс в исследованиях и лечении цитокинового шторма потребует взаимодействия ученых разных областей и сотрудничества экспертов. Кроме того, после достижения достаточного научного прогресса в области персонализированной терапии цитокинового шторма, основанной на биомаркерах, потребуются надежные, быстрые и доступные анализы для измерения уровня воспалительных медиаторов в плазме и тканях.
Резюме
Маленькое вторичное ограничение функционирования органов во время воспалительной реакции является естественным оправданием, если это помогает организму победить инфекцию и выжить. Однако, если воспалительная реакция вызывает чрезмерные нарушения органов, которые могут угрожать выживанию и способности организма к размножению (когда отсутствует искусственная вентиляция легких и диализ), то это следует считать патологическим состоянием. Существуют разнообразные регуляторные механизмы, которые регулируют иммунный ответ и предотвращают развитие цитокинового шторма. Однако, такое расстройство по-прежнему может возникнуть из-за искусственных причин, патогенов, развития онкологического процесса, аутоиммунных реакций и автовоспалительных механизмов. Для адекватного лечения необходимо различать защитные воспалительные реакции и патологический цитокиновый шторм, что на практике является достаточно сложной задачей. Не существует однозначного определения цитокинового шторма, и мнения по поводу того, как должно быть данное определение и следует ли включать определенные состояния, такие как COVID-19, в спектр заболеваний, сопровождающихся цитокиновым штормом, различаются. Авторы этого обзора предлагают единое определение цитокинового шторма, основанное на следующих критериях: повышенные уровни циркулирующих цитокинов, острые системные воспалительные симптомы и нарушение функционирования вторичных органов выше нормы в ответ на наличие патогена. Терапевтические подходы к цитокиновому шторму, связанному с идиопатической мультицентрической болезнью Каслмана, Гемофагоцитарным лимфогистиоцитозом или терапией CAR-Т-клетками, позволили изменить ранее смертельные состояния в преходящие. Учитывая достижения в области многомерного профилирования и терапевтической регуляции иммунной системы, а также координированные исследования цитокинового шторма, можно ожидать дальнейшего улучшения результатов в понимании его патогенеза и лечения.