окрелизумаб рецепт на латыни
Окрелизумаб (Ocrelizumab)
Входит в состав таких препаратов, как ОКРЕВУС. Подробнее о препаратах.
CD20 представляет собой поверхностный антиген, расположенный на пре-В-клетках, зрелых В-клетках и В-клетках памяти. CD20 не экспрессируется на стволовых лимфоидных клетках и плазматических клетках.
Точный механизм, посредством которого достигается терапевтический клинический эффект окрелизумаба при рассеянном склерозе, точно не установлен. Предполагается, что данный механизм включает процесс иммуномодуляции путем уменьшения количества и подавления функции В-клеток, экспрессирующих CD20. После связывания на поверхности В-клеток, экспрессирующих CD20, окрелизумаб селективно уменьшает их количество посредством антителозависимого клеточного фагоцитоза, антителозависимой клеточной цитотоксичности, комплементзависимой цитотоксичности и апоптоза. Способность к восстановлению В-клеток и существующий гуморальный иммунитет сохраняются. Кроме того, окрелизумаб не влияет на врожденный иммунитет и общее количество Т-клеток.
В результате клинических исследований было установлено, что окрелизумаб снижает среднегодовую частоту рецидивов, а также долю пациентов с прогрессированием инвалидизации через 12 недель после начала терапии, замедляет прогрессирование заболевания и снижает ухудшение показателей скорости ходьбы по сравнению с плацебо.
При анализе на иммуногенность антитерапевтические антитела определялись приблизительно у 1% пациентов, из них нейтрализующие антитела определялись в единичных случаях. Оценить влияние возникших во время лечения антитерапевтических антител на профиль безопасности и эффективности терапии не представлялось возможным из-за низкой частоты встречаемости указанных антител к окрелизумабу.
Фармакокинетические свойства окрелизумаба в исследованиях при рассеянном склерозе описаны с помощью двухкамерной модели с зависимым от времени клиренсом и с использованием фармакокиннетических параметров, характерных для моноклонального антитела класса IgG1. Суммарные значения AUC в течение 24-недельных интервалов дозирования были идентичными при двукратном введении (300 мг, затем через 2 недели еще 300 мг) и при однократном введении (600 мг) окрелизумаба. Значение площади AUC после 4 введения окрелизумаба в дозе 600 мг составило 3510 мкг/мл×сут. Средняя C max составляла 212 мкг/мл при рецидивирующих формах рассеянного склероза (инфузия 600 мг) и 141 мкг/мл при первично-прогрессирующем рассеянном склерозе (две отдельные в/в инфузии по 300 мг с 2-недельным интервалом).
Рассчитанное значение центрального V d составило 2.78 л. Рассчитанные значения периферического V d и межкамерного клиренса составили 2.68 л и 0.294 л/сут соответственно.
Отдельных исследований метаболизма окрелизумаба не проводилось. Как и другие антитела, окрелизумаб преимущественно подвергается катаболизму.
Рассчитанный показатель постоянного клиренса составил 0.17 л/сут. Первоначальный зависимый от времени клиренс составил 0.0489 л/сут с дальнейшим уменьшением при T 1/2 33 недели. Терминальный T 1/2 составил 26 дней.
Рецидивирующие формы рассеянного склероза или первично-прогрессирующего рассеянного склероза.
Окревус концентрат для инфузий 30мг/мл 10мл N1
Инструкция по применению Окревус концентрат для инфузий 30мг/мл 10мл N1
Для лечения больных с первично-прогрессирующим рассеянным склерозом.
Форма выпуска
концентрат для приготовления раствора для инфузий
Показания к применению
Препарат Окревус показан для лечения взрослых пациентов с рецидивирующими формами рассеянного склероза или с первично-прогрессирующим рассеянным склерозом.
Рекомендации по применению
Инфузию препарата Окревус следует проводить под тщательным наблюдением опытного медицинского работника и при наличии доступа к средствам для оказания экстренной помощи в случае возникновения тяжелых реакций, таких как серьезные инфузионные реакции. Необходимо наблюдать за пациентом в течение, по меньшей мере, одного часа после завершения инфузии на предмет развития инфузионных реакций (см. раздел «Особые указания», подраздел «Инфузионные реакции»).
Препарат Окревус вводят только внутривенно (в/в) капельно через отдельный катетер. Вводить препарат Окревус струйно или болюсно нельзя.
Премедикация для профилактики инфузионных реакций
Перед каждым введением препарата Окревус следует проводить премедикацию метилпреднизолоном (или эквивалентным лекарственным препаратом) в дозе 100 мг внутривенно (в/в) приблизительно за 30 минут до инфузии для снижения частоты и тяжести инфузионных реакций (см. раздел «Особые указания»).
С целью дальнейшего снижения частоты и тяжести инфузионных реакций рекомендуется проводить дополнительную премедикацию антигистаминным препаратом (например, дифенгидрамином) приблизительно за 30-60 минут до каждой инфузии препарата Окревус. В случае клинической необходимости рекомендуется включить премедикацию антипиретиком (например, ацетаминофеном/парацетамолом) примерно за 30-60 минут до начала каждой инфузии препарата Окревус.
Рекомендуемая доза препарата Окревус составляет 600 мг каждые 6 месяцев в виде в/в инфузии.
Начальную дозу следует вводить в виде двух отдельных в/в инфузий: с первой инфузией вводят 300 мг препарата, затем через 2 недели вводят еще 300 мг препарата.
Все последующие дозы препарата Окревус в дальнейшем вводятся в виде однократной в/в инфузии в дозе 600 мг каждые 6 месяцев. Первую из последующих доз следует проводить через 6 месяцев после 1-ой инфузии начальной дозы.
Минимальный интервал между каждым введением препарата Окревус должен составлять 5 месяцев.
Применение при беременности и кормлении грудью
Женщины с сохранной репродуктивной функцией должны использовать эффективные методы контрацепции в период лечения препаратом Окревус и в течение 6 месяцев после последней инфузии препарата.
Окрелизумаб предположительно проникает через плацентарный барьер, так как относится к иммуноглобулинам подтипа G1.
Не следует применять окрелизумаб во время беременности.
Изменение числа В-клеток у новорожденных, матери которых получали окрелизумаб, не изучалось в клинических исследованиях. Данные контролируемых исследований окрелизумаба с участием беременных женщин отсутствуют.
У некоторых новорожденных, матери которых получали другие антитела к CD20 во время беременности, наблюдались временное истощение пула периферических В-клеток и лимфоцитопения.
Период грудного вскармливания
Неизвестно, выводится ли окрелизумаб с грудным молоком и оказывает ли влияние на его выработку. Потенциальный вред для ребенка, находящегося на грудном вскармливании, не установлен.
Окрелизумаб проникает в молоко животных.
Не рекомендуется грудное вскармливание во время терапии препаратом Окревус, поскольку человеческий IgG проникает в грудное молоко, а возможность всасывания окрелизумаба и последующего истощения пула В-клеток неизвестна.
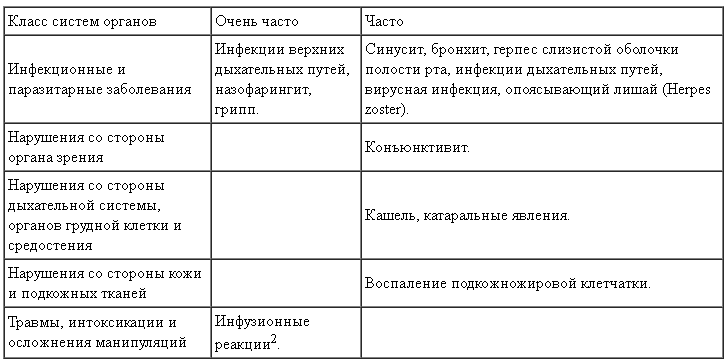
Побочные действия
В Таблице 1 представлены объединенные данные о нежелательных реакциях (НР) у пациентов с рецидивирующими формами РС и с первично-прогрессирующим РС, которые наблюдались в клинических исследованиях препарата Окревус. Наиболее частыми НР были инфузионные реакции и инфекции дыхательных путей.
Для описания частоты нежелательных реакций используется следующая классификация: очень частые (≥1/10), частые (≥1/100 и 45 мл/мин) были включены в программу клинических исследований. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Пациенты с нарушением функции печени
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции печени легкой степени тяжести были включены в клинические исследования. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Состав
Активное вещество: окрелизумаб – 300 мг;
Вспомогательные вещества: натрия ацетата тригидрат – 21.4 мг, уксусная кислота ледяная – 2.5 мг, α,α-трегалозы дигидрат – 400.0 мг, полисорбат 20 – 2.0 мг, вода для инъекций до 10 мл.
Противопоказания
Срок доставки: завтра (при наличии товара на складе)
Регистрационный номер
Торговое наименование
Международное непатентованное наименование
Лекарственная форма
Концентрат для приготовления раствора для инфузий
Состав
1 мл концентрата содержит 30 мг окрелизумаба.
Описание
Прозрачная или слегка опалесцирующая жидкость от бесцветного до слегка коричневатого цвета.
Фармакотерапевтическая группа
Рассеянного склероза средство лечения.
Код АТХ
Фармакологические свойства
СD20 представляет собой поверхностный антиген, расположенный на пре-В-клетках, зрелых В-клетках и В-клетках памяти. СD20 не экспрессируется на стволовых лимфоидных клетках и плазматических клетках.
Точный механизм, посредством которого достигается терапевтический клинический эффект окрелизумаба при рассеянном склерозе (РС), полностью не установлен. Предполагается, что данный механизм включает процесс иммуномодуляции путем уменьшения количества и подавления функции В-клеток, экспрессирующих СD20. После связывания на поверхности В-клеток, экспрессирующих СD20, окрелизумаб селективно уменьшает их количество посредством антителозависимого клеточного фагоцитоза, антителозависимой клеточной цитотоксичности, комплементзависимой цитотоксичности и апоптоза. Способность к восстановлению В-клеток и существующий гуморальный иммунитет сохраняются. Кроме того, окрелизумаб не влияет на врожденный иммунитет и общее количество Т-клеток.
Фармакодинамические эффекты
К 14 дню терапии препаратом Окревус® наблюдалось быстрое истощение пула СD 19+ В-клеток в крови, которое сохранялось в течение всего периода лечения и являлось ожидаемым фармакологическим эффектом. Для подсчета количества В-клеток используется именно СD 19, так как окрелизумаб препятствует распознаванию СD 20 при проведении анализа (см. подраздел «Механизм действия» выше).
В периодах между введениями препарата Окревус® наблюдалось восстановление пула В-клеток (до исходного значения или выше нижней границы нормы (НГН)), как минимум, однажды приблизительно у 5% пациентов.
Степень и длительность истощения пула В-клеток в исследованиях при первичнопрогрессирующем рассеянном склерозе (ППРС) и рецидивирующих формах рассеянного склероза были сходными.
По результатам наиболее длительного периода наблюдения с момента последней инфузии препарата Окревус® (исследование II фазы, N=51) медиана периода восстановления пула В-клеток (возвращения НГН или к исходному значению, если оно меньше НГН) составила 72 недели (27-175 недель). У 90% пациентов пул В-клеток восстановился до значений НГН или исходного значения приблизительно через два с половиной года после последней инфузии препарата.
Клинические исследования при рецидивирующих формах рассеянного склероза
Профиль эффективности и безопасности препарата Окревус® оценивали у пациентов с рецидивирующими формами рассеянного склероза (согласно диагностическим критериям МакДональда 2010) в двух рандомизированных, двойных слепых клинических исследованиях с идентичным дизайном, с двойной имитацией и с использованием активного препарата сравнения (интерферон бета-1а).
Окрелизумаб в дозе 600 мг каждые 24 недели по сравнению с терапией интерфероном бета-1а в дозе 44 мкг подкожно 3 раза в неделю значимо снижал среднегодовую частоту рецидивов (показатели среднегодовой частоты рецидивов составили 0.155-0.156 и 0.290-0.292, соответственно), а также долю пациентов с прогрессированием инвалидизации через 12 недель после начала терапии (9.8% и 15.2%, соответственно).
Клинические исследования при первично-прогрессирующем рассеянном склерозе (ППРС)
Профиль эффективности и безопасности препарата Окревус® оценивали в ходе рандомизированного, двойного слепого, плацебо-контролируемого клинического исследования при участии пациентов с первично-прогрессирующим РС. Результаты данного исследования показали, что окрелизумаб в дозе 600 мг каждые 6 месяцев значимо замедляет прогрессирование заболевания и снижает ухудшение показателей скорости ходьбы в сравнении с плацебо.
Иммуногенность
У пациентов, участвующих в исследованиях рассеянного склероза (РС), проводили тестирование на наличие антитерапевтических антител (АТТ) в нескольких временных точках (перед первым введением и каждые 6 месяцев в течение всего исследования). Из 1311 пациентов, получавших лечение окрелизумабом, положительный результат анализа на АТТ отмечался у 12 пациентов (
1%), из которых у 2 пациентов положительный результат анализа отмечался на нейтрализующие антитела. Оценить влияние возникших во время лечения АТТ на профиль безопасности и эффективности терапии не представляется возможным из-за низкой частоты встречаемости АТТ к препарату Окревус®.
Данные по иммуногенности в значительной степени зависят от чувствительности и специфичности использованных методов анализа. Кроме того, на фактическую частоту встречаемости положительных результатов при использованном методе анализа могут влиять несколько факторов, включая обращение с образцом, время забора образцов, лекарственное взаимодействие, прием сопутствующих препаратов и основное заболевание. Таким образом, сравнение частоты встречаемости антител к препарату Окревус® и частоты встречаемости антител к другим препаратам может быть некорректным.
Влияние на фертильность
Окрелизумаб не оказывал влияния на репродуктивную систему самцов и эстральный цикл самок яванских макак.
Фармакокинетика
Пациенты с рецидивирующими формами рассеянного склероза получали препарат Окревус® в дозе 600 мг каждые 6 месяцев (первая доза вводилась в виде двух отдельных внутривенных (в/в) инфузий: 300 мг препарата, затем через 2 недели еще 300 мг препарата, а последующие дозы вводились в виде однократной в/в инфузии 600 мг препарата).
Пациенты с ППРС получали препарат Окревус® в дозе 600 мг (первая и все последующие дозы вводились в виде двух отдельных в/в инфузий: 300 мг препарата, затем через 2 недели еще 300 мг препарата).
Фармакокинетические (ФК) свойства окрелизумаба в исследованиях при рассеянном склерозе (РС) описаны с помощью двухкамерной модели с зависимым от времени клиренсом и с использованием ФК параметров, характерных для моноклонального антитела класса IgG 1. Суммарные значения площади под кривой «концентрация-время» (АUС) в течение 24-недельных интервалов дозирования были идентичными при двукратном введении (300 мг, затем через 2 недели еще 300 мг) и при однократном введении (600 мг) препарата. Значение площади под кривой «концентрация-время» за период дозирования (АUСt) после 4-го введения окрелизумаба в дозе 600 мг составило 3510 мкг/мл*сут. Средняя максимальная концентрация (Cmax) составляла 212 мкг/мл при рецидивирующих формах рассеянного склероза (инфузия 600 мг) и 141 мкг/мл при ППРС (две отдельные внутривенные инфузии по 300 мг с 2-х недельным интервалом).
Всасывание
Окрелизумаб вводится внутривенно. Другие пути введения препарата не изучались.
Распределение
Рассчитанное значение центрального объема распределения составило 2.78 л. Рассчитанные значения периферического объема распределения и межкамерного клиренса составили 2.68 л и 0.294 л/сут, соответственно.
Метаболизм
Отдельных исследований метаболизма окрелизумаба не проводилось. Как и другие антитела, окрелизумаб преимущественно подвергается катаболизму.
Выведение
Рассчитанный показатель постоянного клиренса составил 0.17 л/сут. Первоначальный зависимый от времени клиренс составил 0.0489 л/сут с дальнейшим уменьшением при периоде полувыведения 33 недели. Терминальный период полувыведения составил 26 дней.
Фармакокинетика у особых групп пациентов
Дети
Исследований фармакокинетики окрелизумаба у детей и подростков в возрасте 45 мл/мин) были включены в программу клинических исследований. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Пациенты с нарушением функции печени
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции печени легкой степени тяжести были включены в клинические исследования. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Показания к применению
Препарат Окревус® показан для лечения взрослых пациентов с рецидивирующими формами рассеянного склероза или с первично-прогрессирующим рассеянным склерозом.
Противопоказания
1 Интерферон бета-1а в исследованиях при рецидивирующих формах рассеянного склероза или плацебо в исследованиях при ППРС.
2 Симптомы, о которых сообщалось как об инфузионных реакциях в течение 24 часов после инфузии, описаны ниже в подразделе «Инфузионные реакции».
Инфузионные реакции
Наблюдались следующие симптомы, связанные с инфузионными реакциями: зуд, сыпь, крапивница, эритема, приливы, понижение артериального давления, повышение температуры тела, повышенная утомляемость, головная боль, головокружение, раздражение горла, боль в ротоглотке, одышка, отек глотки или гортани, тошнота, тахикардия. В контролируемых клинических исследованиях случаев фатальных инфузионных реакций не было.
В клинических исследованиях при рецидивирующих формах рассеянного склероза инфузионные реакции были самыми частыми нежелательными явлениями на фоне терапии препаратом Окревус® в дозе 600 мг. Общие частоты инфузионных реакций составили 34.3% и 9.9% на фоне лечения препаратом Окревус® и интерфероном бета-1а, соответственно. Частота инфузионных реакций была максимальной во время 1-ой инфузии 1-ой дозы препарата Окревус® (27.5%) и снижалась со временем до
Окрелизумаб рецепт на латыни
— ОКРЕВУС быстро подавляет признаки активности заболевания у пациентов с рецидивирующим рассеянным склерозом (РРС)
— У пациентов с недавно установленным диагнозом РРС (ранняя стадия заболевания) и без предшествующего лечения, ОКРЕВУС превосходит Ребиф® (интерферон бета-1а) в отношении контроля активности заболевания
— ОКРЕВУС продемонстрировал снижение показателя утомляемости у пациентов с первично прогрессирующим рассеянным склерозом (ППРС) по сравнению с плацебо
— В расширенной открытой фазе исследования более 2200 пациентов с первично-прогрессирующим и рецидивирующим РС ОКРЕВУС продолжил демонстрировать благоприятный профиль польза-риск
Компания «Рош» (SIX: RO, ROG; OTCQX: RHHBY) объявила о новых данных программы клинических исследований препарата ОКРЕВУС™ (окрелизумаб) на прошедшей 69-й ежегодной конференции Американской академии неврологии (AAN), которая прошла в Бостоне (штат Массачусетс, США). Были представлены дополнительные результаты эффективности и безопасности по препарату ОКРЕВУС по данным исследований II-III фазы, а также расширенной открытой фазы исследований. Данные этих четырех исследований дополнительно поддерживают ОКРЕВУС как возможный вариант лечения пациентов с рецидивирующей или первично прогрессирующей формами рассеянного склероза (РС).
По результатам объединенного экспериментального анализа данных исследований III фазы OPERA I и OPERA II, в течение первых восьми недель лечения препаратом ОКРЕВУС частота рецидивов снизилась на 55 % по сравнению с препаратом Ребиф® (интерферон бета-1а) (p=0,0045). В отдельном исследовании II фазы с участием пациентов с рецидивирующе-ремиттирующим РС, при сравнении с плацебо, ОКРЕВУС продемонстрировал быстрое и почти полное подавление МРТ-признаков активности заболевания в головном мозге через восемь недель, включая новые активные зоны поражения (T1-очаги с контрастированием гадолинием) и новые или вновь увеличившиеся области поражения (гиперинтенсивные T2 очаги).
НАШИ КНИГИ
Другие журналы
«Издательства ОКИ»
Окрелизумаб
Фармакологическое действие
Механизм действия
Окрелизумаб — рекомбинантное гуманизированное моноклональное антитело, селективно воздействующее на B-клетки, экспрессирующие CD20.
CD20 представляет собой поверхностный антиген, расположенный на пре-B-клетках, зрелых B-клетках и B-клетках памяти. CD20 не экспрессируется на стволовых лимфоидных клетках и плазматических клетках.
Точный механизм, посредством которого достигается терапевтический клинический эффект окрелизумаба при рассеянном склерозе (PC), полностью не установлен. Предполагается, что данный механизм включает процесс иммуномодуляции путём уменьшения количества и подавления функции B-клеток, экспрессирующих CD20. После связывания на поверхности B-клеток, экспрессирующих CD20, окрелизумаб селективно уменьшает их количество посредством антителозависимого клеточного фагоцитоза, антителозависимой клеточной цитотоксичности, комплементзависимой цитотоксичности и апоптоза. Способность к восстановлению B-клеток и существующий гуморальный иммунитет сохраняются. Кроме того, окрелизумаб не влияет на врождённый иммунитет и общее количество T-клеток.
Фармакодинамические эффекты
К 14 дню терапии препаратом наблюдалось быстрое истощение пула CD19+ B-клеток в крови, которое сохранялось в течение всего периода лечения и являлось ожидаемым фармакологическим эффектом. Для подсчёта количества B-клеток используется именно CD19, так как окрелизумаб препятствует распознаванию CD20 при проведении анализа (см. подраздел «Механизм действия» выше).
В периодах между введениями препарата наблюдалось восстановление пула B-клеток (до исходного значения или выше нижней границы нормы (НГН)), как минимум, однажды приблизительно у 5 % пациентов.
Степень и длительность истощения пула B-клеток в исследованиях при первичнопрогрессирующем рассеянном склерозе (ПИРС) и рецидивирующих формах рассеянного склероза были сходными.
По результатам наиболее длительного периода наблюдения с момента последней инфузии препарата (исследование II фазы, N=51) медиана периода восстановления пула B-клеток (возвращения НГН или к исходному значению, если оно меньше НГН) составила 72 недели (27–175 недель). У 90 % пациентов пул B-клеток восстановился до значений
НГН или исходного значения приблизительно через два с половиной года после последней инфузии препарата.
Клинические исследования при рецидивирующих формах рассеянного склероза
Профиль эффективности и безопасности препарата оценивали у пациентов с рецидивирующими формами рассеянного склероза (согласно диагностическим критериям МакДональда 2010) в двух рандомизированных, двойных слепых клинических исследованиях с идентичным дизайном, с двойной имитацией и с использованием активного препарата сравнения (интерферон бета-1а).
Окрелизумаб в дозе 600 мг каждые 24 недели по сравнению с терапией интерфероном бета-1а в дозе 44 мкг подкожно 3 раза в неделю значимо снижал среднегодовую частоту рецидивов (показатели среднегодовой частоты рецидивов составили 0,155–0,156 и 0,290–0,292, соответственно), а также долю пациентов с прогрессированием инвалидизации через 12 недель после начала терапии (9,8 % и 15,2 %, соответственно).
Клинические исследования при первично-прогрессирующем рассеянном склерозе (ППРС)
Профиль эффективности и безопасности препарата оценивали в ходе рандомизированного, двойного слепого, плацебо-контролируемого клинического исследования при участии пациентов с первично-прогрессирующим PC. Результаты данного исследования показали, что окрелизумаб в дозе 600 мг каждые 6 месяцев значимо замедляет прогрессирование заболевания и снижает ухудшение показателей скорости ходьбы в сравнении с плацебо.
Иммуногенность
У пациентов, участвующих в исследованиях рассеянного склероза (PC), проводили тестирование на наличие антитерапевтических антител (ATT) в нескольких временных точках (перед первым введением и каждые 6 месяцев в течение всего исследования). Из 1311 пациентов, получавших лечение окрелизумабом, положительный результат анализа на ATT отмечался у 12 пациентов (
1 %), из которых у 2 пациентов положительный результат анализа отмечался на нейтрализующие антитела. Оценить влияние возникших во время лечения ATT на профиль безопасности и эффективности терапии не представляется возможным из-за низкой частоты встречаемости ATT к препарату.
Данные по иммуногенности в значительной степени зависят от чувствительности и специфичности использованных методов анализа. Кроме того, на фактическую частоту встречаемости положительных результатов при использованном методе анализа могут влиять несколько факторов, включая обращение с образцом, время забора образцов, лекарственное взаимодействие, приём сопутствующих препаратов и основное заболевание. Таким образом, сравнение частоты встречаемости антител к препарату и частоты встречаемости антител к другим препаратам может быть некорректным.
Влияние на фертильность
Окрелизумаб не оказывал влияния на репродуктивную систему самцов и эстральный цикл самок яванских макак.
Фармакокинетика
Пациенты с рецидивирующими формами рассеянного склероза получали препарат в дозе 600 мг каждые 6 месяцев (первая доза вводилась в виде двух отдельных внутривенных инфузий: 300 мг препарата, затем через 2 недели ещё 300 мг препарата, а последующие дозы вводились в виде однократной внутривенной инфузии 600 мг препарата).
Пациенты с ППРС получали препарат в дозе 600 мг (первая и все последующие дозы вводились в виде двух отдельных внутривенных инфузий: 300 мг препарата, затем через 2 недели ещё 300 мг препарата).
Фармакокинетические свойства окрелизумаба в исследованиях при рассеянном склерозе описаны с помощью двухкамерной модели с зависимым от времени клиренсом и с использованием фармакокинетических параметров, характерных для моноклонального антитела класса IgGl. Суммарные значения AUC (Area Under Curve — площадь под кривой «концентрация-время») в течение 24-недельных интервалов дозирования были идентичными при двукратном введении (300 мг, затем через 2 недели ещё 300 мг) и при однократном введении (600 мг) препарата. Значение AUC за период дозирования (AUCt) после 4-го введения окрелизумаба в дозе 600 мг составило 3 510 мкг/мл×сут. Средняя максимальная концентрация (Cmax) составляла 212 мкг/мл при рецидивирующих формах рассеянного склероза (инфузия 600 мг) и 141 мкг/мл при ППРС (две отдельные внутривенные инфузии по 300 мг с 2-х недельным интервалом).
Абсорбция
Окрелизумаб вводится внутривенно. Другие пути введения препарата не изучались.
Распределение
Рассчитанное значение центрального объёма распределения составило 2,78 л. Рассчитанные значения периферического объёма распределения и межкамерного клиренса составили 2,68 л и 0,294 л/сут, соответственно.
Биотрансформация
Отдельных исследований метаболизма окрелизумаба не проводилось. Как и другие антитела, окрелизумаб преимущественно подвергается катаболизму.
Элиминация
Рассчитанный показатель постоянного клиренса составил 0,17 л/сут. Первоначальный зависимый от времени клиренс составил 0,0489 л/сут с дальнейшим уменьшением при периоде полувыведения 33 недели. Терминальный период полувыведения составил 26 дней.
Фармакокинетика у особых групп пациентов
Исследований фармакокинетики окрелизумаба у детей и подростков в возрасте младше 18 лет не проводилось.
Пациенты пожилого возраста
Исследований фармакокинетики окрелизумаба у пациентов в возрасте старше 65 лет не проводилось.
Пациенты с нарушением функции почек
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции почек лёгкой степени тяжести (клиренс креатинина >45 мл/мин) были включены в программу клинических исследований. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Пациенты с нарушением функции печени
Отдельных исследований фармакокинетики не проводилось. Пациенты с нарушением функции печени лёгкой степени тяжести были включены в клинические исследования. Изменений фармакокинетических параметров окрелизумаба у таких пациентов не наблюдалось.
Показания
Лечение взрослых пациентов с рецидивирующими формами рассеянного склероза или с первично-прогрессирующим рассеянным склерозом.
Противопоказания
Повышенная чувствительность к окрелизумабу; активный гепатит B; беременность; лактация; детский возраст до 18 лет.
С осторожностью
Застойная сердечная недостаточность (класс III и IV по классификации Нью-Йоркской Ассоциации по изучению заболеваний сердца); иммунизация живыми и живыми ослабленными вирусными вакцинами; возраст пациентов старше 65 лет; нарушение функции почек средней и тяжёлой степени тяжести.
При применении препарата может быть повышен риск малигнизации, включая риск развития рака молочной железы.
Беременность и грудное вскармливание
Контрацепция
Женщины с сохранной репродуктивной функцией должны использовать эффективные методы контрацепции в период лечения окрелизумабом и в течение 6 месяцев после последней инфузии препарата.
Беременность
Окрелизумаб предположительно проникает через плацентарный барьер, так как относится к иммуноглобулинам подтипа G1.
Не следует применять окрелизумаб во время беременности.
Изменение числа B-клеток у новорождённых, матери которых получали окрелизумаб, не изучалось в клинических исследованиях. Данные контролируемых исследований окрелизумаба с участием беременных женщин отсутствуют.
У некоторых новорождённых, матери которых получали другие антитела к CD20 во время беременности, наблюдались временное истощение пула периферических B-клеток и лимфоцитопения.
Период грудного вскармливания
Неизвестно, выводится ли окрелизумаб с грудным молоком и оказывает ли влияние на его выработку. Потенциальный вред для ребёнка, находящегося на грудном вскармливании, не установлен.
Окрелизумаб проникает в молоко животных.
Не рекомендуется грудное вскармливание во время терапии препаратом, поскольку человеческий IgG проникает в грудное молоко, а возможность всасывания окрелизумаба и последующего истощения пула В-клеток неизвестна.
Способ применения и дозы
Режим дозирования индивидуальный, в зависимости от показаний и лекарственной формы.
Побочные действия
Побочные реакции у взрослых пациентов с первично-прогрессирующим рассеянным склерозом с частотой не менее 5 % для окрелизумаба и выше, чем в группе плацебо: инфекции верхних дыхательных путей, инфузионные реакции, инфекции кожи, инфекции нижних дыхательных путей, кашель, понос, периферические отёки, герпетические инфекции.
Взаимодействие
Ожидается, что совместное использование окрелизумаба с другими иммуномодулирующими средствами или иммунодепрессантами, включая иммунодепрессантные дозы кортикостероидов, повысит риск развития иммуносупрессии.
При переходе с терапии препаратами с пролонгированными иммунными эффектами, такими как даклизумаб, финголимод, натализумаб, терифлуномид или митоксантрон, необходимо учитывать продолжительность и механизм действия этих препаратов из-за возможных аддитивных иммунодепрессивных эффектов.
Меры предосторожности
Инфузионные реакции
Окрелизумаб может вызывать инфузионные реакции, которые могут включать в себя зуд, сыпь, крапивницу, эритему, бронхоспазм, раздражение горла, орофарингеальную боль, одышку, отёк глотки или гортани, покраснение, гипотонию, лихорадку, усталость, головную боль, головокружение, тошноту и тахикардию. В клинических испытаниях частота инфузионных реакций у составляла 34–40 %, с самой высокой частотой при первой инфузии. Фатальных инфузионных реакций не наблюдалось, но у 0,3 % пациентов, получавших окрелизумаб, отмечались серьёзные инфузионные реакции, некоторые из которых потребовали госпитализации.
Необходимо наблюдать за состоянием пациентов во время инфузии и в течение как минимум одного часа после завершения инфузии. Информировать пациентов, что инфузионные реакции могут произойти в течение до 24 часов после инфузии.
Инфекции
Окрелизумаб увеличивает риск развития инфекций верхних и нижних дыхательных путей, кожных инфекций и герпетических инфекций. Необходимо откладывать введение препарата у пациентов с активной инфекцией, до её разрешения.
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ)
Прогрессирующая многоочаговая лейкоэнцефалопатия — это оппортунистическая вирусная инфекция головного мозга, вызванная вирусом Джона Каннингема (JC), который обычно встречается только у пациентов с ослабленным иммунитетом и обычно приводит к смерти или тяжёлой инвалидности. Хотя в клинических испытаниях окрелизумаба не было выявлено случаев ПМЛ, инфицирование вирусом JC наблюдалось у пациентов, получавших другие анти-CD20-антитела и другие виды терапии рассеянного склероза, и было ассоциировано с некоторыми факторами риска (ослабленный иммунитет, терапия иммунодепрессантами). Типичные симптомы ПМЛ прогрессируют в течение нескольких дней или недель и включают в себя прогрессирующую слабость одной стороны тела или неповоротливость конечностей, нарушение зрения, нарушения мышления, памяти и ориентации, ведущие к путанице и изменению личности.
Реактивация вируса гепатита B (HBV)
Вакцинация
Вакцинация может быть произведена не менее чем за 6 недель до начала терапии окрелизумабом.
Безопасность иммунизации живыми или живыми аттенуированными вакцинами после терапии окрелизумабом не изучалась, вакцинация живыми аттенуированными или живыми вакцинами не рекомендуется во время лечения окрелизумабом.
Малигнизация
В контролируемых исследованиях злокачественные опухоли, включая рак молочной железы, чаще встречались у пациентов, принимавших окрелизумаб. Рак молочной железы наблюдался у 6 из 781 женщин, получавших окрелизумаб, и ни у одной из 668 женщин, получавших интерферон бета-1a или плацебо. Пациенты должны следовать стандартным рекомендациям по скринингу рака молочной железы.
Влияние на способность к вождению автотранспорта и управлению механизмами
Влияние препарата на способность управлять автомобилем и работать с механизмами не изучалось.