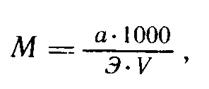нитрат серебра как приготовить раствор
Приготовление раствора серебра нитрата (0,1 моль/л)
1 мл раствора содержит 0,01699 г серебра нитрата.
Приготовление.17 г серебра нитрата растворяют в воде в мерной колбе вместимостью 1 л и доводят объем раствора водой до метки.
Установка титра.Около 0,15 г (точная навеска) натрия хлорида, дважды перекристаллизованного из воды и слабо прокаленного в тигле при температуре от 250 до 300 °С, растворяют в 50 мл воды, и титруют приготовленным раствором серебра нитрата до появления красноватого осадка (индикатор — калия хромат). Молярность раствора вычисляют по первому способу.
Хранить в сосудах темного стекла с притертыми пробками в защищенном от света месте.
Концентрацию раствора вычисляют одним из указанных ниже способов.
Первый способ — по навеске химически чистого вещества. Молярность (М, моль/л) вычисляют по следующей формуле:
где а — навеска химически чистого вещества в граммах;
Э — молярная масса условных частиц химически чистого вещества в граммах на моль;
V — объем раствора, пошедшего на титрование навески, в миллилитрах;
1000 — количество миллилитров в 1 л раствора.
Второй способ — по титрованному раствору известной концентрации.
Молярность (Му мюль/л) вычисляют по следующей формуле:
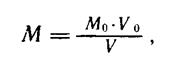
Мо — молярность раствора вещества по которому устанавливается титр, моль/л;
Vo — объем раствора, по которому устанавливается титр, в миллилитрах;
V — объем раствора, молярность которого устанавливают, в миллилитрах.
Для приготовленных титрованных растворов вычисляют поправочный коэффициент к молярности (К), представляющий собой отношение реально полученной концентрации титрованного раствора к теоретически заданной. Коэффициент К должен находиться в пределах от 0,98 до 1,02. При отклонении величины К от указанных пределов растворы необходимо соответственно укрепить или разбавить.
В описании каждого титрованного раствора указывается теоретическое содержание химически чистого вещества в 1 мл раствора.[фф]
Методики количественного определения порошков калия хлорида натрия бромида, калия бромида, калия йодида.
Калия хлорид
1 мл 0,1 н. раствора нитрата серебра соответствует 0,007456 г КС1, которого в препарате должно быть не менее 99,5%,
Натрия бромид
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01029 г NaBr, которого в высушенном препарате должно быть не менее 99,0% и не более 100,6 %
Калия бромид
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01190 г КВr, которого в высушенном препарате должно быть не менее 99,0%) и не более 100,6%.
Калия йодид
Около 0,3 г препарата (точная навеска), предварительно высушенного при 110° в течение 4 часов, растворяют в 30 мл воды, прибавляют 1,5 мл разведенной уксусной кислоты, 5 капель 0,1% раствора эозината натрия и титруют 0,1 н. раствором нитрата серебра до перехода окраски осадка от желтой до розовой.
1 мл 0,1 н. раствора нитрата серебра соответствует 0,01660 г KI, которого в высушенном препарате должно быть не менее 99,5%.
Методики определения доброкачественности порошков калия хлорида натрия бромида, калия бромида, калия йодида.
Калия хлорид
Прозрачность и цветность раствора. 16 г препарата растворяют в 160 мл свежепрокипяченной и охлажденной воды. Полученный раствор-должен быть прозрачным и бесцветным.
Кислотность или щелочность. К 50 мл того же раствора прибавляют 5 капель раствора бромтимолового синего и 0,1 мл 0,02 н. раствора едкого-натра; должно появиться голубое окрашивание. К другим 50 мл того же раствора прибавляют 5 капель раствора того же индикатора и 0,1 мл 0,02 н. раствора соляной кислоты; должно появиться желтое окрашивание.
Соли аммония. 2,5 мл того же раствора, разведенные водой до 5 мл, не должны давать реакцию на соли аммония.
Кальций. 10 мл того же раствора не должны содержать кальция более чем 2 мл эталонного раствора, разведенные водой до 10 мл (не более 0,006% в препарате).
Магний. 5 мл того же раствора не должны давать мути от прибавления 0,5 мл раствора аммиака и раствора фосфата натрия.
Барий. 10 мл того же раствора не должны давать помутнения с разведенной серной кислотой при наблюдении в течение 2 часов.
Железо. 10 мл того же раствора не должны содержать железа более чем 1 мл эталонного раствора, разведенный водой до 10 мл (не более 0,0003% в препарате).
Тяжелые металлы. 10 мл того же раствора должны выдерживать испытание на тяжелые металлы (не более 0,0005% в препарате).
Сульфаты. Раствор 2 г препарата в 10 мл воды должен выдерживать испытание на сульфаты (не более 0,005% в препарате).
Натрий. 5% раствор препарата не должен окрашивать бесцветное пламя в желтый цвет.
Мышьяк. 1 г препарата должен выдерживать испытание на мышьяк (не более 0,00005% в препарате).
Калия бромид
Щелочность. 1 г препарата растворяют в 10 мл свежепрокипяченной и охлажденной воды, прибавляют 0,1 мл 0,1 н. раствора соляной кислоты; раствор не должен окрашиваться в розовый цвет ни на холоду, ни при кипячении от прибавления 1 капли раствора фенолфталеина.
Сульфаты. 3 г препарата растворяют в 30 мл воды. 10 мл этого раствора должны выдерживать испытание на сульфаты (не более 0,01% в препарате).
Йодиды. 5 мл того же раствора, разведенные водой до 10 мл, не должны окрашиваться в синий цвет в течение 10 минут от прибавления 3 капель раствора хлорида окисного железа и нескольких капель раствора крахмала.
Барий, кальций, броматы. К 5 мл того же раствора прибавляют 1 мл концентрированной серной кислоты. Раствор должен быть прозрачным и не должен окрашиваться в желтый цвет в течение 5 минут.
Тяжелые металлы. 5 мл того же раствора, разведенные водой до 10 мл, должны выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).
Железо. Раствор 3 г препарата в 10 мл воды должен выдерживать испытание на железо (не более 0,001% в препарате).
Потеря в весе при высушивании. Около 1 г (точная навеска) растертого в мелкий порошок препарата сушат при 120° до постоянного веса. Потеря в весе не должна превышать 1%.
Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более 0,0001% в препарате).
Натрия бромид
Прозрачность и цветность раствора, щелочность, сульфаты, йодиды. барий, кальций, броматы, тяжелые металлы, железо, мышьяк. Препарат должен выдерживать испытания, указанные в статье «Калия бромид».
Потеря в весе при высушивании. Около 0,5 г (точная навеска) растертого в мелкий порошок препарата сушат при 110° в течение 4 часов. Потеря в весе не должна превышать 4%.
Калия йодид
Прозрачность и цветность раствора. 1 г препарата растворяют в 10 мл свежепрокипяченной и охлажденной воды. Раствор должен быть прозрачным и бесцветным.
Щелочность. К полученному раствору прибавляют 0,2 мл 0,02 н. раствора соляной кислоты; раствор не должен окрашиваться в розовый цвет от прибавления 1 капли раствора фенолфталеина.
Сульфаты. 3 г препарата растворяют в 30 мл воды. 10 мл этого раствора должны выдерживать испытание на сульфаты (не более 0,01% в препарате).
Цианиды. К 5 мл того же раствора прибавляют 5 капель раствора сульфата записного железа, 2 капли раствора хлорида окисного железа, 1 мл раствора едкого натра и слегка нагревают. После подкисления соляной кислотой раствор не должен окрашиваться в синий цвет.
Барий. К 5 мл того же раствора, разведенным водой до 10 мл. прибавляют 1 мл разведенной соляной кислоты и 1 мл разведенной серной кислоты. Раствор должен оставаться прозрачным в течение 15 минут.
Тяжелые металлы. 5 мл того же раствора, разведенные водой до 10 мл, должны выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).
Железо. Раствор 3 г препарата в 10 мл воды должен выдерживать испытание на железо (не более 0,001% в препарате).
Йодноватая кислота, тиосульфат, сульфит. 0,5 г препарата растворяют в 10 мл свежепрокипяченной и охлажденной воды, прибавляют несколько капель раствора крахмала и разведенной серной кислоты. В течение полминуты не должно появляться синее окрашивание, заметное при рассматривании жидкости по оси пробирки. Синее окрашивание должно появиться от прибавления не более 1 капли 0,1 н. раствора йода.
Нитраты. К 1 г препарата прибавляют 5 мл раствора едкого натра, 0,5 г цинковых и 0,5 г железных опилок и нагревают. Влажная красная лакмусовая бумага в парах жидкости не должна окрашиваться в синий цвет.
Потеря в весе при высушивании. Около 1 г (точная навеска) растертого в мелкий порошок препарата сушат при 110° в течение 4 часов. Потеря в весе не должна превышать 1%.
Мышьяк. 1 г препарата должен выдерживать испытание на мышьяк (не более 0,0001% в препарате).
Серебрение в домашних условиях

Гальваническое серебрение металла минимально требует использования серебряного электролита и анода из чистого серебра. Лучше всего использовать специальные аноды, но можно обойтись и серебром из банковских серебряных слитков. Чистота слитков достаточна для прокатки и их использования в качестве анода. Размеры анодной пластины для гальванической ванны выбирают исходя из размера изделий, которые будут подвергаться серебрению. Соотношение площадей анод-катод должно в идеальном случае составлять 1:1. В редких случаях можно отойти от этого правила, но учесть возможные отклонения во времени обработки и силе тока на ванне. Самая распространенная ошибка с использованием слишком маленького анода — отлуп, то есть отслоение серебряного металлического слоя. Именно поэтому важно соблюдать правило соотношения площадей изделия и анода для работы.
Серебрение изделий редко проводят в домашних условиях. Это связано с едкими компонентами растворов и особенностями осаждения серебра из электролита. Кроме того, кроме непосредственно серебрения, потребуется линейка подготовительных растворов. За редким исключением, это необходимость, а не дань схеме из учебника по покрытию металлов. Подготовительные растворы очень сложно приготовить в домашних условиях. Дополнительная трудность заключается в том, что для различных металлов линейка подготовительных операций отличается.
Если Вы когда-либо интересовались вопросом серебрения в домашних условиях, то наверняка встречали статьи о простоте и доступности этого процесса. В качестве доступных компонентов упоминается:
Конечно, если Вам повезло жить рядом с не слишком щепетильным магазином химических реактивов или Вы работаете на химическом предприятии, то достать такие реактивы несложно. Составление электролита для серебрения в домашних условиях важно проводить с использованием средств индивидуальной защиты, на химически инертной поверхности и под мощной вытяжной вентиляцией. В качестве растворителя используют только дистиллированную или бидистиллированную воду. Очищенная в домашних условиях вода не подойдет. Содержание в воде даже небольшого количества ионов хлора недопустимо, это приведет к выпадению серебра в виде хлорида в нерастворимый осадок и невозможности провести серебрение металла.
Растворы для серебрения в домашних условиях
Электролитов для серебрения на предприятнии и в домашних условиях существует множество видов. Самая простая классификация: цианистые и бесцианистые растворы. Цианистые электролиты превосходят бесцианистые по всем показателям, она дают мелкозернистые, блестящие, хорошо адгезированные покрытия. Во всех случаях, когда есть возможность применять цианистый электролит это предпочтительнее, по сравнению с использованием менее ядовитых бесцианистых растворов.
Крайне не рекомендуется использование серебра на основе цианидов в домашних условиях!
Бесцианистые растворы для серебрения можно разделить на две категории: со связанными цианидами и не содержащие цианогруппы. Самыми известными считаются роданистые, борфтористые, виннокислые растворы. Выбор электролита определяется исходя из требований к серебряному покрытию и исходного материала изделия. Самым простым и стабильным раствором для бесцианистого серебрения в домашних условиях является электролит на основе роданистого калия. Он обеспечивает хорошую адгезия покрытия, мелкозернистые осадки, широкий диапазон применяемых токов. Для всех электролитов серебрения справедливо правило: температурный режим не выше 25 градусов цельсия. Нагревание растворов серебра приводит к укрупнению зерна осадка и ухудшению прилипания в поверхности изделия. Составы электролитов могут отличаться в различных источниках.
В компании ООО «6 микрон» все электролиты разработаны на основе большого количества опытных работ. Составы уникальны и рецептуры не разглашаются. Возможно приготовление электролита серебрения для конкретного металла или задачи производства заказчика.
Нанесение серебряного покрытия в ванне в домашних условиях
Серебрение металла гальваническим методом наносят в ванных погружного типа с приложением электрического тока. Серебрение химическим способом не дает плотного, равномерного, качественного слоя серебра. Адгезия также будет минимальной. Самый известный способ серебрения в домашних условиях — это осаждение серебра без приложения тока на медную или латунную поверхность.
Этапы серебрения в домашних условиях путем осаждения:
Цвет покрытия при таком способе обработки от грязно-серого до желтоватого. Это не значит, что медь проглядывает из-под серебра, это говорит о том, что толщина слоя очень мала и составляет менее 1 мкм. Любые заверения в том, что таким способом можно нанести 10-20 микрон серебра не более чем слова. В целях декоративной отделки металла или в технических задачах серебро наносят не менее 5 мкм, так как ввиду мягкости покрытия износостойкость достигается только толщиной слоя серебра. Если толщина серебрения менее 1 мкм, это говорит о невозможности использования изделия. Даже в чисто декоративных целях этот способ нельзя применять. Дело в том, что серебро и медь имеют большое сродство поверхностей, именно поэтому серебрение в домашних условиях можно наносить на медь без подслоя. Но есть и обратная сторона этого же свойства: похожая кристаллическая решетка объясняет диффузию тонкого слоя серебра в основу из меди. Изделие в серебре толщиной менее 1 мкм со временем (обычно от 1 месяца до полугода) становится розовым, то есть возвращается цвет металлической меди. Серебро диффундирует в медь и на поверхности остаются только атомы меди. Это не говорит о том, что покрытие облезло, отслоилось или стерлось, это просто свойство тонкого слоя серебра, нанесенного на поверхность меди.
Обратите внимание, все видео на тему серебрения в домашних условиях сняты как раз для нанесения серебрения на медь или медный сплав, но на словах автор комментирует, что это можно проделать и с другими металлами: со сталью и даже с алюминием. Ни одного видео на эту тему нет, только слова и заверения в успехе.
Конечно, это не случайность и не просто пример работы в домашних условиях. Химическое серебро можно наносить только на медные сплавы. Со сталью не запустится реакция осаждения металлического серебра, а алюминий дополнительно к неудачному покрытию испортит электролит серебрения, так как этот металл растворяется в щелочных и кислотных растворах. Если Вы все же решите попробовать нанести серебрение в домашних условиях, выбирайте медный сплав. Качество покрытия можно проверить только если серебрение удалось нанести.
Нанесение паст для серебрения в домашних условиях
Этот метод используют для нанесения серебрения в домашних условиях с помощью широко распространенных серебросодержащих паст. Самым простым примером служит ляписный карандаш. Принцип осаждения серебра из него тот же что и при химическом серебрении из растворов. Медь, имея сродство к серебру будет вступать в обменную реакцию и на поверхности детали появится черно-серый тонкий слой серебра. Все минусы химического покрытия в это случае сохраняются. Серебрение в домашних условиях пастами, карандашами и т.п средствами не дает положительного качественного результата.
Даже если все сложилось, расходники закуплены и есть вытяжка на кухне мы крайне не рекомендуем готовить электролиты в домашних условиях. Это опасно для исполнителя, его семьи и экологии. Будьте внимательны и берегите свое здоровье.
Нанесение серебра гальваническим карандашом
Покрытие, наносимое внатирку при помощи гальванического карандаша называют трибогальваническим. На уровне технологии трибогальваника совпадает с классической гальванической ванной. Для процесса требуется:
Раствор для трибогальваники насыщен серебром по сравнению с электролитом для ванны. Анод как и для ванны требуется из чистого серебра, чистотой не менее 9999. Насадку для карандаша лучше использовать из искусственных материалов, хлопок вступает в реакцию с электролитом серебрения, растворяется, портит электролит и остается волокнами на поверхности изделий. Лучшим вариантом для насадки на карандаш является синтепоновая волокнистая ткань. Заменять тканевую насадку перед следующей работой не нужно, после обработки и высыхания ее нужно просто замочить в дистиллированной воде.
Для трибогальваники серебром в домашних условиях обязательно потребуются средства личной защиты и вытяжная вентиляция. Следует принять во внимание, что внатирку можно нанести только небольшую толщину серебра, максимум 2-3 мкм.
Технологи компании ООО «6 микрон» категорически не рекомендуют Вам использовать электролиты серебра для серебрения в домашних условиях. Это опасно для здоровья работника, его близких и экологии. Будьте внимательны к себе и обращайтесь к профессионалам по вопросам серебрения. Специалисты помогут Вам решить проблему быстро, качественно и в оговоренные сроки.
Нитрат серебра как приготовить раствор
ПОЛУЧЕНИЕ НИТРАТА СЕРЕБРА ИЗ ВТОРИЧНОГО СЫРЬЯ
Автор работы награжден дипломом победителя II степени
В настоящее время в современных школах (особенно в сельских и деревенских) существует проблема заказа и доставки химических реактивов. Одним из наиболее дорогостоящих и используемых в школьном химическом практикуме является нитрат серебра (I). Стоимость его за 1 г составляет от 25 до 45 рублей. Цена колеблется в зависимости от изготовителя и удалённости фирмы производителя от заказчиков.
Нитрат серебра (I) в школьном химическом практикуме используется при проведении ярких качественных реакций в неорганической и органической химии [1]. Поэтому отсутствие его в школьной лаборатории – это огромный минус «химической наглядности».
Таким образом, целью работы являлось получение нитрата серебра (I) в условиях школьной лаборатории.
Где же взять такой драгоценный металл как серебро?! Известно, что серебро содержится в рентгеновских снимках, проявленных фотоплёнках, в фотографиях [2]. Именно из них, в несколько стадий, был получен нитрат серебра (I).
1. Используя литературные источники, определить вторичное сырье для получения нитрата серебра
2. Получить нитрат серебра из различных объектов
3. Сравнить выход продуктов реакции
4. Провести качественные реакции с полученным в условиях школьной лаборатории нитратом серебра (I).
Глава I. Литературный обзор
1. 1 Серебро и его свойства
Серебро стало известно значительно позднее золота, хотя так же встречается в самородном состоянии. В Египте археологами найдены серебреные украшения, относящиеся ещё к додинастическому периоду (5000 – 3400 до н. э.). Однако долгое время серебро было большой редкостью и ценилось дороже золота.
Чистое серебро не темнеет на воздухе, а вот серебро с примесью может достаточно быстро потемнеть (рис. 1) [2].
Рис. 1. Серебреное изделие из ювелирного магазина (А) и после некоторого ношения человеком (Б).
Потемнение указывает на наличие серы в воздухе, например, при загрязнении воздуха или болезни обладателя серебреного предмета. После золота серебро является самым лёгким по обработке металлом. Из 30 граммов серебра можно вытянуть проволоку длиной более 50 км. Это также самый лучший из известных проводников тепла и электроэнергии [4].
Соединения серебра часто не устойчивы к нагреванию и действию света. Открытие светочувствительности солей серебра привело к появлению фотографии и быстрому увеличению спроса на серебро. Ещё в середине 20 века почти половина всего добытого серебра шла на изготовление кино- и фотоматериалов. Одним из соединений серебра является ляпис [5].
1.2 Применение нитрата серебра в медицине
Нитрат серебра, ляпис (AgNO3) − бесцветный (белый) порошок, хорошо растворимый в воде, на свету он чернеет с выделением металлического серебра (рис. 2) [3].
Рис. 2. Внешний вид нитрата серебра
Впервые ляпис был применён в XVII веке врачами-алхимиками: голландец Ян-Батист Ван Гельмонт и немец Франциск де ла Бое Сильвий. Они научились получать нитрат серебра взаимодействием металла с азотной кислотой. Учёные обнаружили, что прикосновение к кристаллам полученной серебряной соли приводит к появлению на коже чёрных пятен, а при длительном контакте – глубоких ожогов (рис. 3). Поэтому это вещество прозвали «адским камнем».
Рис. 3. Образование чёрных пятен при прикосновении к нитрату серебра.
Адский камень – не чистый нитрат серебра, а его сплав с нитратом калия, иногда отливается в виде палочек – ляписного карандаша. Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов; в небольших концентрациях он действует как противовоспалительное и вяжущее средство.
Ранее серебра нитрат применяли при хроническом гастрите и язвенной болезни желудка и двенадцатиперстной кишки (внутрь, в виде 0,05% раствора). Раствор (2%) может использоваться для профилактики гонококковой инфекции глаз у новорожденных [2].
1.3 Вторичное серебросодержащее сырьё
Основными поставщиками серебросодержащего сырья являются химическая, радио- и электротехническая промышленности; производства: ювелирное, часовое и зеркальное, а также рентгеновские кабинеты в медицинских поликлиниках.
Серебросодержащие отходы фото- и кинопромышленности образуются в процессе изготовления, обработки и порчи светочувствительных материалов или износа кинолент и фотоотпечатков.
Отходы химической промышленности поступают в виде отработанных контактных масс (20-80% Ag); отработанных катализаторов (более 80% Ag); шламов (от 60 до 80% Ag); лома серебряной аппаратуры (20-25% Ag).
Образование серебросодержащих отходов в зеркальной промышленности происходит в процессе серебрения зеркал, елочных украшений и так далее [3].
Большое количество серебросодержащего сырья (до 30-40% Ag) перерабатывается в виде отходов электронной и электротехнической отраслей промышленности: вышедшие из строя серебряно-цинковые и серебряно-кадмиевые аккумуляторы (от 30 до 60%); сплавы-контакты, серебряные припои (от 5 до 99%); металлокерамические композиции 25-50.
Кроме перечисленных отходов на переработку поступают другие виды сырья, резко различающиеся химическими и физическими свойствами.
Глава II. Объекты и методы исследования
2.1 Объекты исследования
В качестве объектов исследования для получения реактива нитрата серебра были использованы рентгеновские снимки, фотоплёнка, ёлочная игрушка, зеркало (рис. 4).
Рис. 4. Вторичное серебросодержащее сырьё:
А. Рентгеновские снимки. Б. Фотоплёнка.
2.2 Методика получения нитрата серебра из рентгеновских снимков и фотоплёнок
Рентгеновские снимки и фотоплёнку резали на мелкие кусочки и отмеряли на весах по 17 граммов каждого. Далее подготовленный материал растворяли в азотной кислоте (концентрированной) (рис. 5).
Рис. 5. Растворение рентгеновских снимков в азотной кислоте.
После растворения объектов приливали раствор поваренной соли. Полученный осадок промывали водой и заливали раствором хлороводородной кислоты. После чего в осадок клали гранулы цинка для проведения реакции замещения. По завершении реакции, полученный порошок промывали и высушивали. Высушенное серебро растворяли в растворе азотной кислоты, затем выпаривали и растворяли в дистиллированной воде [1].
2.3 Методика получения нитрата серебра из серебросодержащих изделий
Ёлочную игрушку и зеркало очищали от различного рода загрязнений и заливали раствором азотной кислоты до растворения (рис. 6). Полученный раствор выпаривали и получали порошок, который прокаливали в фарфоровой чашке. К остуженному расплаву приливали воды, и полученный раствор нитрата серебра сливали.
Рис. 6. Растворение ёлочной игрушки в растворе азотной кислоты.
2.4 Методика проведения качественных реакций на галогенид-ионы
К растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы приливали раствор полученного нитрата серебра. Наблюдали выпадение осадков.
2.5 Методика проведения реакции «серебряного зеркала»
К раствору аммиачного нитрата серебра добавляли примерно столько же глюкозы и нагревали содержимое пробирки до образования осадка на стенках.
Глава III. Результаты и их обсуждение
3.1 Результаты получения нитрата серебра из рентгеновских снимков и фотоплёнок
После добавления концентрированной азотной кислоты ионы серебра выделились в раствор. Далее при приливании к полученному раствору хлорида натрия происходило образование белого осадка (1) (рис. 7):
Ag + + NaCl → AgCl↓ + Na + (1).
Рис. 7. Образование белого осадка хлорида серебра.
После окончательного промывания и осаждения хлорида серебра к осадку с соляной кислотой добавляли гранулы цинка, что способствовало образованию серебра (2):
2AgCl↓ + Zn → ZnCl2 + 2Ag↓ (2)
После добавления к образовавшемуся серебру разбавленной азотной кислоты происходило образование нитрата серебра и выделение газа (3):
После выпаривания нитрата серебра, в случае с рентгеновской плёнкой его масса составила 1,2 грамма. В случае с фотоплёнкой масса нитрата серебра составила 0,8 граммов.
3.2 Результаты получения нитрата серебра из серебросодержащих изделий
Содержащееся на поверхности изделий серебро растворилось в растворе азотной кислоты полностью: от зеркала осталось прозрачное стекло. Теперь в растворе находятся соли серебра и меди. Чтобы избавиться от примеси солей меди, раствор выпарили и прокалили до образования оксида меди (II) (4) (рис. 8):
Рис. 11. Выпаривание раствора солей серебра и меди.
После приливали воду, нитрат серебра растворялся, а оксид меди оставался в виде осадка. Полученный раствор слили в склянку с надписью AgNO3.
3.3 Результаты проведения качественных реакций на галогенид-ионы с полученным нитратом серебра
После приливания нитрата серебра к растворам солей, содержащих хлорид-ионы, бромид-ионы, иодид-ионы происходило образование белого (5), светло-жёлтого (6) и жёлтого осадков (7) соответственно (рис. 9):
Рис. 9. Качественные реакции на галогенид-ионы. А. Хлорид-ионы. Б. Бромид-ионы. В. Иодид-ионы
3.4 Результаты проведения реакции «серебряного зеркала»
После добавления к аммиачному раствору серебра глюкозы и нагревании смеси, произошло выпадение осадка серебра на стенках пробирки (8):
Это свидетельствует о том, что в ходе исследования действительно был получен нитрат серебра.
ВЫВОДЫ
1. Исходя из литературных источников, сырьём для получения нитрата серебра являются рентгеновские снимки, фотоплёнки, ёлочные игрушки, зеркала.
2. Чистый нитрат серебра был получен из рентгеновских снимков и фотоплёнок.
3. Выход нитрата серебра, полученного из рентгеновских снимков оказался больше, чем при получении из фотоплёнок.
4. Были проведены качественные реакции с помощью полученного нитрата серебра.
5. При острой необходимости, нитрат серебра можно получить в школьной лаборатории.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
2. Польза серебра для здоровья [Электронный ресурс]. – Лаборатория омоложения – Режим доступа: http://www.deus1.com/serebro.html
4. Харитонов Ю. Я. Аналитическая химия. – М.: Высшая школа, 2001.