лицевая сторона ппк к рецепту
Лицевая сторона ппк к рецепту
Согласно правилам оформления ППК [4] все расчёты входящих в рецептурную пропись ингредиентов должны производиться до изготовления лекарственной формы на его оборотной стороне. Лицевая же сторона ППК «заполняется немедленно после изготовления лекарственной формы по памяти на латинском языке в соответствии с последовательностью технологических операций». При этом в документе не указывается, в каком падеже должны быть перечислены в ППК ингредиенты, что является причиной неоднозначного понимания данного пункта документа технологии. По-видимому, следует исходить из того, что фармацевт, вспоминает надпись на этикетке использованного штангласа, на котором, как известно, название ингредиента приводится в именительном падеже. Следовательно, и в ППК все взятые лекарственные и вспомогательные вещества необходимо указывать именно в именительном (Nominativus), а не в родительном (Genetivus), как в рецептурной прописи, падеже.
Вторая особенность оформления лицевой стороны ППК касается вопроса перечисления на его лицевой стороне всех указанных в рецептурной прописи и использованных при изготовлении лекарственной формы ингредиентов в соответствии с последовательностью их использования. При этом каждое вещество должно фигурировать в ППК лишь единожды, т.к. оно, как правило, отвешивается или отмеривается однократно. Последующее же поэтапное использование всего взятого количества ингредиента должно соответствующим образом быть отображено в ППК. Например, в рецепте выписана 10% стрептоцидовая мазь в количестве 30 г. Обычно фармацевт, заполняя ППК, пишет:
При таком заполнении ППК можно судить лишь о перечне использованных ингредиентов и их количествах, но никак не о технологии изготовления мази.
По существующим правилам данная суспензионная мазь, выписанная в концентрации более 5%, должна быть изготовлена путём первоначального измельчения стрептоцида с частью расплавленной основы, и именно эти особенности технологии и должны найти отражение при заполнении ППК:
Vaselinum ↑ 27,0 t°, q.s. ( * )
Следует отметить, что в вышеозначенном документе [4] не нашёл должного отражения вопрос использования при изготовлении большинства лекарственных форм вспомогательных веществ, не предусмотренных рецептурной прописью. Отмечается лишь необходимость указания в ППК изотонирующих и стабилизирующих веществ, добавляемых в глазные капли или в инъекционные и инфузионные растворы. Учитывая большое разнообразие лекарственных форм аптечного изготовления этого явно недостаточно.
Так, например, при измельчении труднопорошкуемых веществ рекомендовано использование спирта этилового или эфира [6]. В частности, при изготовлении 10 порошков стрептоцида массой по 0,5 г добавление вспомогательной жидкости должно быть отражено на лицевой стороне ППК следующим образом:
Spiritus aethylicus q.s.
Можно привести пример заполнения ППК по рецептурной прописи на микстуру с отражением технологических стадий её изготовления:
Rp.: Infusi herbae Thermopsidis 200,0 ( * )
Liquoris Ammonii anisati ana 4,0
Единственно верным способом введения капель нашатырно-анисовых в жидкую лекарственную форму по приведённой прописи является смешивание их в подставке с примерно равным объёмом водной фазы [5], которую предварительно можно изготовить двумя способами:
2) путём растворения термопсиса экстракта-концентрата сухого (1:1) 0,5 г в 120 мл воды очищенной с последующим добавлением к полученному раствору 80 мл 5% концентрированного раствора натрия гидрокарбоната (1:20).
В первом случае ППК оформляется следующим образом:
Во втором случае ППК оформляется следующим образом:
Резюмируя вышесказанное можно заключить, что надлежащий письменный контроль обеспечивает качество изготавливаемых по рецептам в аптечных учреждениях лекарственных средств и при этом гарантирует оказание своевременной лекарственной помощи населению.
Концентрированные растворы и стандартные жидкости (растворы)
Концентрированные растворы и стандартные жидкости (растворы)
Теоретический материал к занятию
Кислота хлористоводородная разведенная
Acidum hydrochloricum dilutum
Solutio Ammonii caustici
Кислота уксусная разведенная
Acidum aceticum dilutum
Раствор алюминия ацетата основного
Solutio Aluminii subacetatis
Раствор калия ацетата
Solutio Kalii acetatis
Жидкость калия ацетата
Liquor Kalii acetatis
Раствор жидкости калия ацетата
Solutio Liquoris Kalii acetatis
Раствор водорода перекиси концентрированный
Solutio Hydrogenii peroxydi concentrata
Раствор водорода перекиси разведенный
Solutio Hydrogenii peroxydi dilutum
Примечание: таблица дана в приказе МЗ РФ № 000 от 21.10.97г.
Изготовление растворов кислоты хлористоводородной.
Растворы кислоты хлористоводородной любой концентрации изготавливают из кислоты хлористоводородной разведенной (8,2 – 8,4%), принимая ее за единицу (100%).
Кислоту хлористоводородную разведеную используют также для получения раствора 1:10 в качестве внутриаптечной заготовки (концентрация кислоты при этом будет 0,82 – 0,84%). Этот раствор используют для обеспечения более точного дозирования кислоты хлористоводородной разведеной.
Кислоту хлористоводородную с концентрацией 24,8 – 25,2% используют только в тех случаях, когда в прописи рецепта имеется соответствующее указание.
Без дополнительного указания кислота хлористоводородная с концентрацией 24,8 – 25,2% используется только при изготовлении раствора 2 по прописи Демьяновича.
Растворы кислоты хлористоводородной изготавливают в объемной концентрации.
Пример: Rp.: Solutionis Acidi hydrochlorici 3% 180ml
Da. Signa. По 1 столовой ложке перед едой.
Проверка доз раствора кислоты хлористоводородной (вещество списка «Б»):
Высшие дозы кислоты хлористоводородной разведенной: ВРД=2мл, ВСД=6мл
Количество приемов (объем столовой ложки равен 15мл): 180/15=12
Оформление ППК



Работа по изготовлению заканчивается оформлением лицевой стороны паспорта письменного контроля. Заполнение ППК производится по памяти. Все ингредиенты перечисляются в технологической последовательности в именительном падеже на латинском языке. В ППК указываются также все вспомогательные вещества не предусмотренные рецептурной прописью, но которые были использованы для изготовления данного препарата.
Оценка качества изготовленного препарата.
Провизор-технолог проводя оценку качества изготовленного препарата проверяет ППК (расчеты и технологию), оценивает раствор по органолептическим характеристикам (цвет, запах, вкус у детских препаратов, отсутствие механических включений), проводит физический контроль (отклонение в объеме) и химический контроль (качественные реакции на лекарственные вещества). Полный химический контроль проводится в соответствии с приказом № 214 от 1997 г.
ОСОБЫЕ СЛУЧАИ ИЗГОТОВЛЕНИЯ РАСТВОРОВ
Растворы медленнорастворимых веществ. К медленнорастворимым веществам относятся: квасцы, кислота борная, железа сульфат, меди сульфат, натрия сульфат, натрия тетраборат, магния сульфат и др. Растворение затруднено так как вещества имеют прочную кристаллическую решетку, поверхность медленно смачивается растворителем, замедляется диффузия тяжелых ионов. Для ускорения растворения таких веществ недостаточно механического перемешивания. Наиболее целесообразно использовать нагревание а для крупнокристаллических веществ (меди сульфат) измельчение в ступке с небольшим количеством растворителя.
Для растворения свинца ацетата используется свежепрокипяченная вода. К раствору для полного растворения свинца ацетата добавляют 5 капель разведенной уксусной кислоты на 100 мл раствора.
2NaHCO3 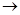
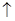
Натрия гидрокарбонат следует растворять методом настаивания или осторожного помешивания стеклянной палочкой, без взбалтывания!
D. S. По 1 столовой ложке 3 раза в день.
20,0 растворятся в Х мл воды Х = 1000 мл
В кипящей воде кальция глюконат растворим 1:5, т.е. для растворения 20 г потребуется 100 мл кипящей воды. Завышен предел растворимости в воде комнатной температуры, но учитывая способность кальция глюконата при нагревании образовывать устойчивые пересыщенные растворы лекарственную форму можно готовить. Раствор фильтруем через бумажный фильтр, так как марлевые салфетки и ватные тампоны не обеспечат полного освобождения от активированного угля. Делаем расчеты на обратной стороне ППК.
Кальция глюконата 10% 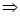
Cмах = 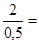
Так как Cмах меньше концентрации, выписанной в рецепте (4%
Оценку качества проводим органолептически: бесцветная прозрачная жидкость без запаха. Отклонения в объеме могут быть в пределах (196 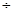
Оформляем лицевую сторону ППК:
Aqua purificata 190,0
Calcii gluconas 20.0
Carbo activatus 1,0
Растворы ртути дихлорида (сулемы). Ртути дихлорид (Hydrargyri dichloridum) относится к особо ядовитым веществам. Храниться в отдельном запирающемся отделении шкафа для хранения ядовитых и наркотических веществ. Растворы ртути дихлорида используются для дезинфекции. Отпускаются из аптек только медперсоналу. Для идентификации растворы подкрашивают эозином или фуксином, о чем следует сделать пометку на этикетке.
Растворы осарсола. Осарсол (Osarsolum) очень мало растворим в воде, но растворим в растворах едких щелочей, аммиака, гидрокарбоната натрия. Поэтому для улучшения его растворения в воду добавляют эквимолярное количество натрия гидрокарбоната:
1 моль осарсола – 1 моль натрия гидрокарбоната
т.е. на 1 г осарсола требуется добавление 0,3 г натрия гидрокарбоната, чтобы добиться полного растворения осарсола. Осарсол относится в веществам списка А.В ассистентской комнате хранится в шкафу для хранения ядовитых и наркотических веществ и отвешивается на специальных весах. Так как осарсол находится на предметно-количественном учёте, списание делают на обороте рецепта при получении осарсола у провизора-технолога. Рецепт остается в аптеке, больному взамен рецепта выдается сигнатура. Лекарственная форма опечатывается и до отпуска больному хранится в закрывающемся шкафу.
Растворы фенола. Фенол чистый (кислота карболовая кристаллическая) Phenolum purum (ГФ 1Х) представляет собой бесцветные, длинные игольчатые
| При изготовлении водных и глицериновых растворов используют фенол жидкий. При изготовлении масляных растворов только фенол кристаллический во избежание ожёгов. |
D.S. Для дезинфекции инструментов.
Выписана жидкая лекарственная форма – истинный раствор. Растворитель не указан, следовательно, используем воду очищенную. Водные растворы фенола готовят с использованием фенола жидкого, которого следует взять на 10% больше, так как он содержит 10% воды. Делаем расчеты:
Фенола кристаллического 1% => 1,0 – 100 мл
Фенола жидкого на 10% больше, то есть
Mфенола жид. = 2,0 + 0,2 = 2,2
Предположим, что при калибровке пипетки установлено соотношение:
| 1,0 фенола жидкого – 22 капли |
Изготовление ведем в отпускном флаконе. Отмериваем 200 мл воды и откапываем 48 капель фенола жидкого. Раствор перемешиваем, герметично укупориваем. Оформляем к отпуску: основная этикетка «Наружное». На этикетке указываем наименование раствора, его концентрацию и назначение раствора.
Растворы фенола отпускают только медперсоналу.
температуре, при нагревании возгоняется, образуя фиолетовые пары. Растворим в воде 1:5000. В медицинской практике используются водные растворы с концентрацией йода 1% и выше. Их получают используя способность йода образовывать водорастворимые комплексы с калия йодидом. Если калия иодид в прописи не указан, то его берут в два раза больше, чем прописано йода. Чаще всего используются водные растворы Люголя.
Раствор Люголя для внутреннего применения (5%):
Йода кристаллического 1,0
Воды очищенной до 20 мл
Изготовление раствора проводят в отпускном флаконе. Отвешивают 2 г калия йодида и переносят в отпускной флакон. Так как растворимость калия йодида в воде 1:0,75, значит для растворения 2 г потребуется 1,5 мл воды (30 капель). Сухих веществ более 3%, поэтому Vводы = 20 – (1,0х0,23 + 2,0х0,25) = 19,27 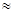
Раствор Люголя для наружного применения (1%):
Йода кристаллического 1,0
Воды очищенной до 100 мл
Технология изготовления аналогичная раствору Люголя для внутреннего применения. Разница будет в объеме растворителя, используемого для изготовления раствора. Так как концентрация сухих веществ 3%, учитываем изменение объема при растворении йода и калия йодида:
Vводы = 100 – (1,0х0,23 + 2,0х0,25) = 99,27 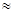
Отпускают растворы йода во флаконах темного стекла. Укупоривают полиэтиленовыми пробками. Корковые пробки йод разрушает даже при
кратковременном контакте. Резиновые пробки разрушает при длительном хранении растворов.
Учитывая растворимость фенобарбитала возможны три варианта изготовления его растворов:
· если концентрация фенобарбитала в растворе более 0,1% и в прописи отсутствуют спиртовые препараты, то фенобарбитал растворяют в растворе натрия гидрокарбоната (используют способность фенобарбитала растворяться в растворах щелочей). Натрия гидрокарбонат добавляют в эквимолярном количестве:
1 моль фенобарбитала – 1 моль натрия гидрокарбоната
Следовательно, 232,24 фенобарбитала – 84,01натрия гидрокарбоната
т.е. на 1 г фенобарбитала добавляют 0,4 г натрия гидрокарбоната.
Rp.: Phenobarbitali 0,2
Aquae purificatae 200,0
Signa. По 1 столовой ложке 2 раза в день.
Концентрация фенобарбитала в растворе 0,1%, так как
0,2 фенобарбитала содержатся в 200 мл раствора
В прописи нет настоек и других спиртовых растворов. Для растворения 0,2 фенобарбитала потребуется 220 мл воды:
для растворения 1,0 фенобарбитала – 1100 мл воды
Это меньше 200 мл воды, выписанной в рецепте, следовательно, фенобарбитал полностью не растворится! Растворы с осадком сильнодействующих и ядовитых веществ отпускать нельзя. Поэтому для растворения фенобарбитала будем использовать натрия гидрокарбонат. Если для растворения 1,0 фенобарбитала требуется 0,4 натрия гидрокарбоната, то для растворения 0,2 фенобарбитала потребуется 0,08 натрия гидрокарбоната. Концентрация лекарственных веществ по рецепту составляет 1,2%:
Это. меньше 3%, поэтому объем растворителя берем столько, сколько указано в рецептурной прописи. В подставку отмериваем 200 мл воды, растворяем 0,08 натрия гидрокарбоната и 0,2 фенобарбитала. После полного растворения веществ раствор процеживаем в отпускной флакон, герметично укупориваем и оформляем к отпуску.
— для растворения веществ используют свежеприготовленную и профильтрованную воду очищенную;
— растворы фильтруют через стеклянные фильтры; бумажные обеззоленные фильтры или ватные тампоны, предварительно промытые горячей водой.
Серебра нитрат является веществом списка А. Его растворы отпускают во флаконах темного стекла в опечатанном виде с дополнительной этикеткой «Обращаться осторожно». Растворы в концентрации более 2% отпускаются только в руки медперсонала (так как обладают сильным прижигающим действием).
Калия перманганат медленно растворим в холодной воде (1:18) и легко растворим в кипящей воде (1:3,5). Если растворы калия перманганата выписаны в концентрации менее 1%, растворы можно готовить в отпускном флаконе, используя для растворения горячую свежеполученную и профильтрованную воду. Если растворы выписаны в концентрации более 1%, изготовление проводят в ступке методом «взмучивания»: калия перманганат помещают в ступку и измельчают с горячей водой (на 1г вещества 0,5 мл воды), затем добавляют еще воду и перемешивают. Надосадочную жидкость сливают в отпускной флакон. Оставшийся на дне ступки осадок вновь измельчают, добавляют воду, перемешивают и вновь сливают жидкость с осадка. Операцию повторяют до тех пор, пока не будет измельчен и растворен весь калия перманганат и использован весь объем растворителя. Растворы калия перманганата отпускают во флаконах темного стекля во избежание активации процесса разложения.
пазухи), глазные капли и примочки готовят на изотоническом (0,9%) растворе натрия хлорида.
Da. Signa. Для полоскания горла.
2. Рассчитываем количество фурацилина, необходимое для приготовления раствора:
1,0 фурацилина требуется на 5000 мл раствора
Х фурацилина на 250 мл раствора
В термостойкую колбу отмериваем 250 мл воды очищенной. На специальных весочках для красящих веществ (ВР-1) отвешиваем 0,05 фурацилина и переносим в колбу. Колбу закрываем пергаментом или часовым стеклом и нагреваем до полного растворения фурацилина. Полученный раствор фильтруем через марлевую салфетку в отпускной флакон и оформляем к отпуску. Этикетка «Наружное». Оформляем ППК.
Aqua purificata 250,0
Лицевая сторона ППК



Aquae purificatae 5 ml
Ephedrini hydrochloridi 0,3
Aquae purificatae 4,7 ml
Особенности технологии
Антибиотики, кроме левомицетина, термолабильны, поэтому их вводят в состав глазных капель асептически. Расчет ВО производят с использованием КУО твердых ЛВ, хотя прирост объема (»0,3 мл) укладывается в норму допустимых отклонений (±1 мл). Эфедрина г/х, как ЛВ приравненное к наркотическим, подлежит в глазных каплях количественному анализу, поэтому предпочтение более точному расчету. Раствор эфедрина г/х готовят по общим правилам, согласно прописи № 120, приказ № 214 от 16.07.97, затем в изготовленном стерильном растворе растворяют бензилпенициллин натрий. Полученный раствор фильтруют только в случае необходимости, т.к. бензилпенициллин натрий промышленность выпускает для инъекционного введения (стерильный порошок без механических включений). Глазные капли с бензилпенициллином хранят не более суток (пр. № 214, примечание в конце приказа). Рецепт остается в аптеке, взамен него выписывают сигнатуру.
Задание 3.2.
Фармацевтическая экспертиза рецепта
Проверка фармацевтической совместимости
Проверка доз лекарственных веществ списка А и Б, НЕО учетных веществ
Вывод. Препарат изготавливать ___________.
Оформление ОСР (при необходимости)
Пропись___________________________, МУ от_____________, прил._____________________, раздел_____________________________, пункт___________________. – Раствор ________________%.
Пропись___________________________, приказ№______от_________, прил._____________________, раздел_____________________________, пункт___________________. – Раствор ________________%.
Состав прописи по НД:
Расчеты
Оборотная сторона ППК
Лицевая сторона ППК
Особенности технологии
Задание 3.3.Изготовление глазных примочек
Пример.
Пропись рецепта № 3
Rp.: Solutionis Aethacridini lactatis 0,1% 200 ml
Da. Signa. Глазная примочка
Фармацевтическая экспертиза рецепта
Рецептурный бланк – форма № 107/у
Проверка фармацевтической совместимости
Вывод. В нормированных прописях ингредиенты всегда совместимы.
Проверка доз лекарственных веществ списка А и Б, НЕО учетных веществ
Дозы не проверяют, т.к. наружное применение. Учетных веществ нет.
Вывод. Препарат изготавливать можно.
МУ от 24.08.94, прил…., раздел …., пропись № ….
Приказ МЗ РФ № 214 от 16.07.97, раздел 1.2, пропись № 65, – Раствор этакридина лактата 0,1%
Этакридина лактата 1,0
Воды очищенной до 1 л
Режим стерилизации: 120 0 C – 8 мин (в объеме до 100 мл)
Срок годности: 30 суток
Условия хранения: в защищенном от света месте
Технология изготовления сложных порошков с лекарственными средствами списка «А», красящими, пахучими, труднопорошкуемыми, с экстрактами-концентратами
Ядовитые и сильнодействующие лекарственные средства, технология их изготовления. Предназначение порошков с наркотическими, одурманивающими, сильнодействующими лекарственными веществами. Приготовление лекарственных средств с экстрактами из полуфабрикатов.
| Рубрика | Медицина |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 17.05.2017 |
| Размер файла | 62,3 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Для приготовления данного лекарственного препарата можно использовать полуфабрикат, состоящий из димедрола 0,03 и сахара 0.25.
Расчет: Для получения смеси по рецепту надо взять:
Димедрола 0,03 х10 = 0.3 г
Сахара 0,25 х10 = 2,5 г
Смеси 0,28 Х10 = 2.8 г (серия №)
Отвешивают 2,8 г полуфабрикаты димедрола с сахаром, растирают и смешивают в ступке, выбирают и оставляют примерно 0,3 г (равное эфедрина гидрохлорида), добавляют 0,3 гэфедрина гидрохлорида, полученного по требованию, перемешивают, затем по частям добавляют другое количество полуфабриката.Приготовленную смесь развешивают по 0,31 г в парафинированные капсулы. Сначала пишут требование на эфедрин, затем оформляют ППК (лицевую сторону):
суміші 2,8 (серія №_______)
Ephedrіnі hydrochlorіdі 0,3
В данном случае отпадает необходимость в предварительном измельчении ингредиентов, в смешении розницу с учетом того, что ингредиенты выписаны в резко отличающихся количествах.
1.9 Оформление порошков к отпуску
Проверка качества приготовленных порошков.
Схема проверки качества порошков:
«Правильность выписки рецепта;
«Дозы ядовитых и сильнодействующих веществ.
«Оформление паспорта письменного контроля;
«Однородность, сыпучесть, вкус, цвет, запах;
«Проверка массы порошков;
«Упаковка и оформление к отпуску.
Согласно приказу МЗ РФ 214 провизор-технолог обязан провести обязательные виды контроля: письменный, органолептический, контроль при отпуске. Выборочно: опросный и физический; химический- в соответсвии с требованиями раздела 8 натоящей Инструкции.
При изготовлении лекарственных форм по индивидуальным прописям и требованиям лечебно-профилактических учреждений наиболее часто провизор-технолог использует устный и письменный контроль.
При изготовлении концентратов, полуфабрикатов внутриаптечной заготовок и расфасовки лекарственных средств все записи делаются в книгах учета лабораторных и фасовочных работ.
Органолептический контроль заключается в проверке внешнего вида лекарственной формы, его цвета, вкуса, запаха, однородности смешивания.
Однородность смешивания порошков проверяют к разделению массы на дозы в соответствии с требованиями ГФ. На вкус проверяются лекарственные препараты для внутреннего употребления избирательно и в случае сомнения в качестве изготовленного лекарственного препарата, особое внимание обращается на лекарства для детей.
Физический контроль заключается в общей проверке массы или объема лекарственной формы, количества и массы отдельных доз.
Существует еще химический контроль качества, который осуществляет в аптеке провизоров-аналитик.
Глава 2. Практическая работа
Rp.: Ext. Belladonnae 0,015
Papaverini hydrochloridi 0,03
S.: По 1 порошку 3 раза в день.
Фармэксепртиза прописи рецепта
Рецепт виписан правильно, все ингредиенты совместимы. Веществ, находящихся на предметно количественном учете нет, есть вещества списка «Б»: экстракт красавки, папаверина гидрохлорид и анестезин. Проверяем дозы. лекарственный порошок наркотический полуфабрикат
Экстракт крсавки: ВРД ГФ=0,05; ВРД рец=0,015;
ВСД ГФ=0,15; ВСД рец=0,015*3=0,045.
Папаверина гидрохлорид: ВРД ГФ=0,2; ВРД рец=0,03;
ВСД ГФ=0,6; ВСД рец=0,03*3=0,09.
Анестезин: ВРД ГФ=0,5; ВРД рец=0,3;
ВСД ГФ=1,5; ВСД рец=0,3*3=0,9.
Красткие сведения о физико-химических свойствах лекарственных и вспомогателных веществ
Экстракт красавки (белладонны) сухой- порошок бурого или светло-бурого цвета, слабого своеоб-разного запаха, гигроскопичен.
Оформляем оборотную сторону паспорта письменного контроля (ППК)
m(экстракта красавки (1:2))=0,015*4*2=0,12
1:20=0,12*20-0,12=2,28>1,44, готовим без отсыпания.
Лицевая сторона ППК
Papaverini hydrochloridi 0,12
В ступку №2 на весах ВР-5 отвешиваем 1,2 анестезина, измельчаем и затираем им поры ступки. На ВР-1 отвешиваем 0,12 папаверина гидрохлорида, измельчаем, смешиваем. На ВР-1 отвешиваем 0,12 экстракта красавки сухого (1:2), измельчаем и смешиваем. Скребком собираем порошок в центр ступки, пестиком надавливаем и на расстоянии 25 см смотрим, чтобы порошок был однородным, без вкраплений и блеска. Дальше дозируем по 0,36 в вощенные капсулы числом 4. Помещаем в бумажный пакет и клеим этикетку.
Основные этикетки: «Внутреннее», «Порошки».
Дополнительные этикетки: «Беречь от детей», «Хранить в сухом, защищенном от света месте».
Срок годности 10 дней.
Оценка качесвта изготовенной лекарственной формы
1. Органолептический контроль: порошок желтоватого цвета, горького вкуса, слабо своебразного запаха, однородный.
2. Физический контроль: НДО +/- 5%
Rp.: Ext. Belladonnae 0,015
Papaverini hydrochloridi 0,1
S.: По 1 порошку 3 раза в день.
Фармэксепртиза прописи рецепта
Рецепт виписан правильно, все ингредиенты совместимы. Веществ, находящихся на предметно количественном учете нет, есть вещества списка «Б»: экстракт красавки, папаверина гидрохлорид. Проверяем дозы.
Экстракт крсавки: ВРД ГФ=0,05; ВРД рец=0,015;
ВСД ГФ=0,15; ВСД рец=0,015*3=0,045.
Папаверина гидрохлорид: ВРД ГФ=0,2; ВРД рец=0,1;
ВСД ГФ=0,6; ВСД рец=0,1*3=0,3.
Красткие сведения о физико-химических свойствах лекарственных и вспомогателных веществ
Экстракт красавки (белладонны) сухой- порошок бурого или светло-бурого цвета, слабого своеоб-разного запаха, гигроскопичен.
Оборотная сторона ППК
m(экстракта красавки (1:1))=0,015*4=0,06
спирт этиловый (для измельчения камфоры)
1:20=0,06*20-0,06=1,14 2.04, готовим без отсыпания.
Лицевая сторона ППК
Основные этикетки: «Внутреннее», «Порошки».
Дополнительные этикетки: «Беречь от детей», «Хранить в сухом, защищенном от света месте».
Срок годности 10 дней.
Оценка качесвта изготовенной лекарственной формы
1. Органолептический контроль: белый со слегка желтоватым оттенком однородный порошок, кисло-горького вкуса, со слабым специфическим запахом.
2. Физический контроль: НДО +/- 5%
Rp.: Platyphyllini hydrotartratis 0,003
S.: По 1 порошку 3 раза в день.
Фармэксепртиза прописи рецепта
Рецепт виписан правильно, все ингредиенты совместимы. Веществ, находящихся на предметно количественном учете нет, есть вещество спискоа «А»: платифиллина гидротартрат; и вещества списка «Б»: папаверина гидрохлорид, димедрол, анальгин. Проверяем дозы.
Платифиллина гидротартрат: ВРД ГФ=0,01; ВРД рец=0,003;
ВСД ГФ=0,03; ВСД рец=0,003*3=0,009.
Папаверина гидрохлорид: ВРД ГФ=0,2; ВРД рец=0,02;
ВСД ГФ=0,6; ВСД рец=0,02*3=0,06.
Димедрол: ВРД ГФ=0,2; ВРД рец=0,02;
ВСД ГФ=0,6; ВСД рец=0,02*3=0,06.
Анальгин: ВРД ГФ=1,0; ВРД рец=0,2;
ВСД ГФ=3,0; ВСД рец=0,2*3=0,6.
Красткие сведения о физико-химических свойствах лекарственных и вспомогателных веществ
Оборотная сторона ППК
m(платифиллина гидротартрата)=0,003*4=0,012 1,08, готовим с отсыпанием.
Лицевая сторона ППК
Papaverini hydrochloridi 0,08
Trit. Platyphyllini hydrotartratis 0,12
В ступку №2 на весах ВР-1 отвешиваем 0,8 анальгина, измельчаем и затираем поры ступки. Оставояем в сутпке примерно 0,1 анальгина, остальное отсыпаем на вощеную бумагу. На ВР-1 отвешиваем 0,08 папаверина гидрохлорида, измельчаем и смешиваем. На ВР-1 отвешиваем 0,8 димедрола, измельчаем, смешиваем. На ВР-1 отвешиваем 0,12 тритурации платифиллина гидротартрата, измельчаем и смешиваем. Чатсями добавляем отсыпанное колчиество анальгина и смешиваем. Скребком собираем порошок в центр ступки, пестиком надаавливаем и на расстоянии 25 см смотрим, чтобы порошок был однородным, без вкраплений и блеска. Дальше дозируем по 0,27 в вощенные капсулы числом 4. Помещаем в бумажный пакет, опечатываем и клеим этикетку.
Основные этикетки: «Внутреннее», «Порошки».
Дополнительные этикетки: «Беречь от детей», «Хранить в сухом, защищенном от света месте».
Срок годности 10 дней.
Оценка качесвта изготовенной лекарственной формы
1. Органолептический контроль: белый однородный порошок, горького вкуса, вызывает на языке чувство-онемения, без запаха.
2. Физический контроль: НДО +/- 10%
Rp.: Codeini phosphatis 0,03
S.: По 1 порошку 3 раза в день.
Фармэксепртиза прописи рецепта
Рецепт виписан правильно, все ингредиенты совместимы. Есть вещество списка «Б», находящееся на предметно количественном учете: кодеина фосфат. Норма отпуска 0,2, по рецепту 0,03*4=0,12. Норма отпуска не превышена. Проверяем дозы.
Экстракт крсавки: ВРД ГФ=0,1; ВРД рец=0,03;
ВСД ГФ=0,3; ВСД рец=0,03*3=0,09.
Красткие сведения о физико-химических свойствах лекарственных и вспомогателных веществ
Оборотная сторона ППК
спирт этиловый (для измельчения камфоры)
1:20=0,12*20-0,12=2,28>0,72, готовим без отсыпания.
Лицевая сторона ППК
Sp. Aethylici 90% gtts II
Codeini phosphatis 0,12
В ступку №2 на весах ВР-1 отвешиваем 0,2 камфоры, отмериваем эмпирическим каплемером, предварительно откалиброванным, 2 капели 90% спирта этилового, измельчаем. Отсыпаем камфору из ступки на вощеную бумагу. У провизора-технолога на ВР-1 отвешиваем 0,12 кодеина фосфата. На оборотоной стороне рецепта провизор пишет нзвание и дозу лекарственного вещества, находящегося на ПКУ, которое выдал, и ставит роспись, фармецевт расписписывается за то,что получил 0,12 кодеина фосфата. Измельчаем. На ВР-1 отвешиваем 0,4 сахара, измельчаем, смешиваем. Частями добавляем отсыпанную камфору, измельчаем и смешиваем. Скребком собираем порошок в центр ступки, пестиком надаавливаем и на расстоянии 25 см смотрим, чтобы порошок был однородным, без вкраплений и блеска. Дальше дозируем по 0,18 в пергамнтные капсулы числом 4. Помещаем в бумажный пакет, опечатываем и клеим этикетку.
Основные этикетки: «Внутреннее», «Порошки».
Дополнительные этикетки: «Беречь от детей», «Хранить в сухом, защищенном от света месте».
Срок годности 10 дней.
Оценка качесвта изготовенной лекарственной формы
1. Органолептический контроль: однородный порошок белого цвета, сладко-горького вкуса, с характерным запахом.
2. Физический контроль: НДО +/- 10%
Цель и задачи, поставленные в работе, выполнены.
Рассмотрены частные случаи изготовления порошков, а именно: изготовление порошов с ядовитыми и наркотическими веществами, с красящими, пахучими, труднопорошкуемыми, с экстрактами концентратами
На сегодняшний день в аптеке также изготавливаются порошки, как лекарственная форма, так как они имеют широкое распространение в медицинской практике. Таким образом, можно сделать вывод, что порошки обладают рядом преимуществ по сравнению с другими лекарственными формами.
Список используемой литературы







