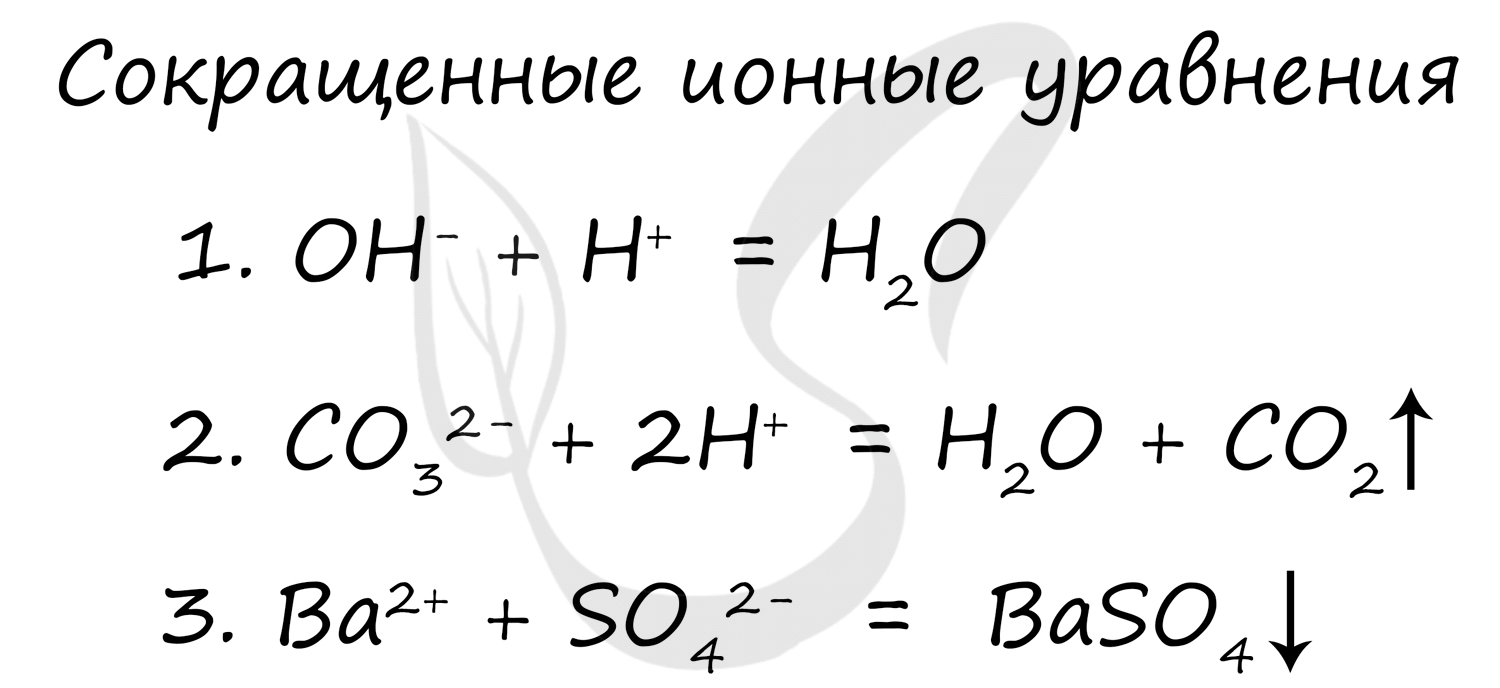Что является конечным продуктом гидролиза
Гидролиз
Основные темы касающиеся гидролиза солей позволяют углубить наши знания в области среды водных растворов, а именно: кислой, щелочной или нейтральной.
Гидролиз – это процесс взаимодейсвуетия второстепенного вещества с водой. Гидролиз могут проходить как неорганические составы, так и органические. Речь идет об широком спектре веществ таких как соли, бинарные соединения, углеводы, жиры белки, эфиры и др. Гидролиз солей проводится тогда, когда ионы соляного соединения формируют ионами воды (ОН−и Н+легкодиссоциирующие электролиты)
И вот какие его возможности
Того сальих гидролиз этой про leaving all radicals when emitted для во вещетп I the compound completely.
About irreversible: practically all initial hydrolysis of particles
To determine the type of hydrolysis, we need to study the salts as a product of the interaction of the base and acid. Any salt consists of a metal and an acid residue. The metal indicates alkaline or amphoteric hydroxide (with the same degree of oxidation as in the salt), and the acidic residue indicates an acid. For example, sodium carbonate Na2CO3 corresponds to the base — alkali NaOH and carbonic acid H2CO3.
Обратимый гидролиз солей
Механизм гидролиза будет зависеть от состава исходной соли. Мы рассмотрим 4 основных варианта:
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) происходит ступенчато и образует кислые соли:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
Продукты гидролиза первой ступени подавляют вторую ступень гидролиза, поэтому она происходит незначительно.
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз второй и особенно третьей ступеней почти не происходит при комнатной температуре.
Вот общая таблица для свода вышеприведенной информации:
Необратимый гидролиз
В случаях гидролиза, когда возникают газы, осадки или вода, иначе говоря, несочетающиеся вещества при данных условиях, происходит необратимый гидролиз. Это химическая реакция, поскольку реагенты взаимодействуют практически полностью.
Имеются следующие варианты необратимого гидролиза:
! Исключения: (соли Ca, Sr, Ba и Fe 2+) — в этом случае происходит обычный обмен:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме — Fe, Ca, Sr, Ba).
Соли Fe3+ при взаимодействии с карбонатами также образуют осадок гидроксида и газ при смешивании:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами происходит окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также происходит окислительно-восстановительная реакция.
Полные уравнения для таких реакций выглядят достаточно сложно. Сначала рекомендуется составить уравнение для обменной реакции без участия воды, а затем разложить полученный продукт обменной реакции водой. Путем сложения этих двух реакций и сокращения одинаковых веществ можно получить полное уравнение для необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов также является необратимым. Галогенангидриды расщепляются водой по схеме ионного обмена (H + OH -) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). При этом степень окисления центрального элемента и других элементов не изменяется!
Галогенангидрид — это соединение, получаемое заменой ОН-группы галогеном в кислоте. При гидролизе галогенангидридов образуются соответствующие кислоты и галогеноводородные кислоты в зависимости от элементов и степени окисления.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т.д.),производные безводных оксидов (ангидридов) вереском аспекта тревоги вызывала.
Если они подвергаются кислотному гидролизу, образуется сероводород и соль металла, например:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алканиневатое число:
Коэффициент растворимости (α) — это отношение концентрации соли, подверженной гидролизу, к общей концентрации растворенной соли. В случае необратимого гидролиза «α»≅1.
Факторы, влияющие на степень гидролиза:
1. Гидролиз и его зависимость от температуры
Гидролиз является эндотермической реакцией, то есть его процесс интенсифицируется при нагревании раствора.
Пример: изменение степени гидролиза раствора 0,01 М CrCl3 при разных температурах:
2. Концентрация соли и степень ее гидролиза
Степень гидролиза соли возрастает при уменьшении ее концентрации.
Пример: изменение степени гидролиза Na2CO3 при разных концентрациях:
Поэтому для предотвращения нежелательного гидролиза рекомендуется хранить соли в концентрированной форме.
3. Влияние добавления кислоты или щелочи на равновесие гидролиза
Изменяя концентрацию одного из продуктов, можно сместить равновесие реакции гидролиза в нужную сторону.
Гидролиз
Есть ли гидролиз по катиону, по аниону или его нет?
Если соль содержит остаток сильного основания и остаток слабой кислоты, то происходит гидролиз по аниону. Здесь некоторые примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет как по катиону, так и по аниону сразу. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Содержание раствора может быть нейтральным, кислым или щелочным. Определяется типом гидролиза. Некоторые задачи могут быть построены таким образом, что при виде соли вы должны определить тип ее раствора.
Тем не менее, следует отметить, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда будет кислой из-за свойств диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда будет щелочной из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить содержание раствора для соединений из самостоятельного задания, которое вы только что выполнили. Ниже будет приведено решение.
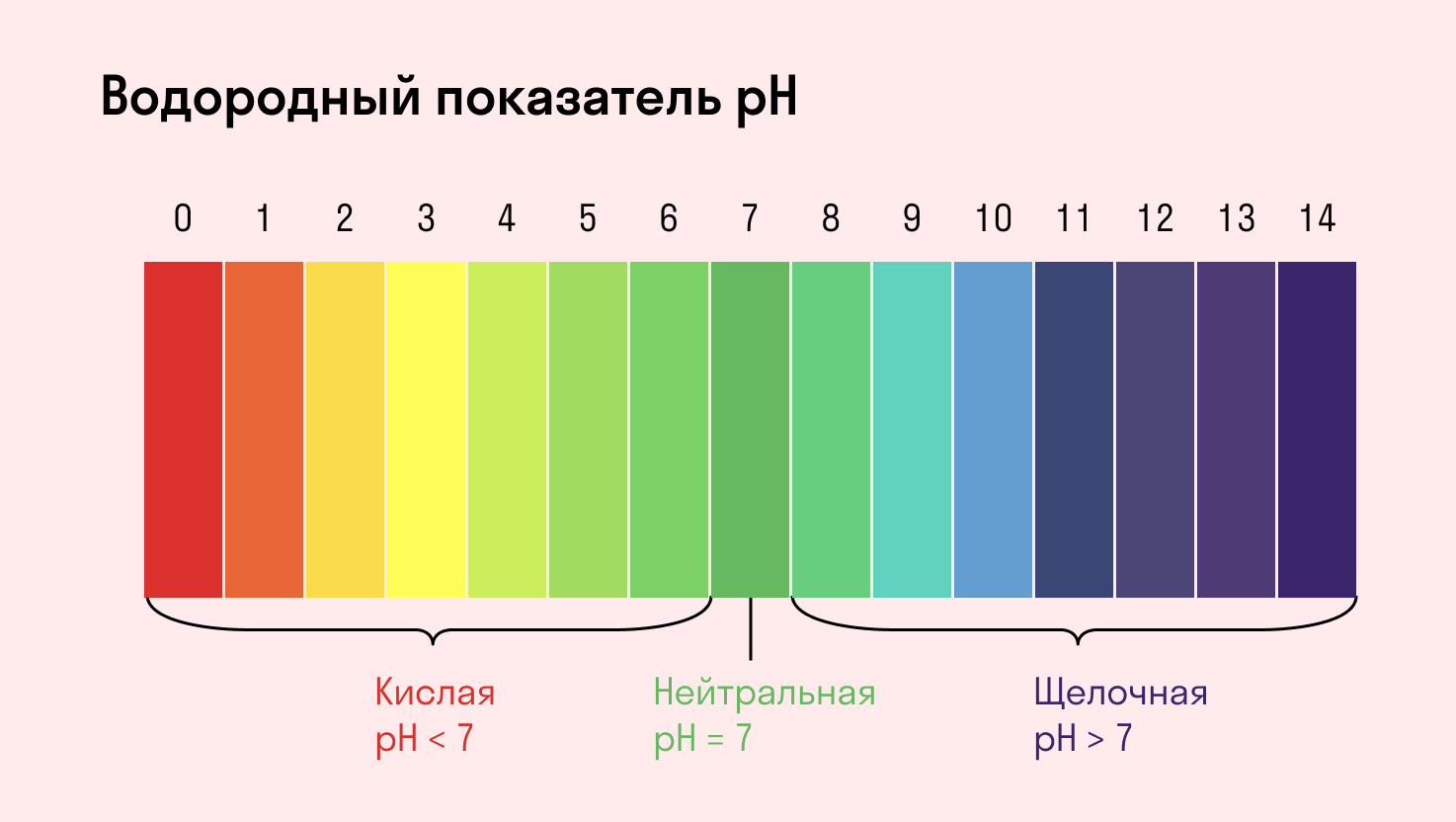
В целях усложнения задач часто могут использоваться синонимы. Так, «содержание раствора» может быть заменено на водородный показатель pH.
Запомните, что кислая среда характеризуется pH 7.
Химия. 11 класс
Конспект урока
7. Взаимодействие органических и неорганических соединений с водой
Список тем для изучения:
В данном уроке будут рассмотрены реакции гидролиза органических и неорганических соединений, условия проведения реакций гидролиза, уравнения реакций гидролиза и равновесие в реакции гидролиза.
Гидролиз – это реакция обмена ионами между молекулами органических или неорганических соединений и водой, при которой исходное соединение разрушается и изменяется состояние окружающей среды.
Жиры представляют собой сложные эфиры многоатомных спиртов, в которых гидроксильные радикалы замещены на кислотные остатки кислородсодержащих кислот.
Константа диссоциации – это константа равновесия процесса диссоциации электролита на ионы, которая равна отношению произведения концентраций образовавшихся ионов к концентрации не disfor ion ионами молекул. Все концентрации возводятся в степени, равные стехиометрическим коэффициентам.
Полный гидролиз – это необратимый процесс разложения вещества водой до образования его соединений.
Сильные электролиты – это соединения, степень диссоциации которых в воде составляет более 30%.
Слабые электролиты – это соединения, степень диссоциации которых в воде не превышает 3%.
Сложные эфиры – это продукты замещения иона водорода в карбоновой кислоте углеводородным радикалом.
Степень диссоциации – это количественная характеристика электролита, которая равна отношению числа диссоциировавших молекул к общему числу молекул в растворе, выраженная в процентах.
Углеводы – это органические соединения, которые содержат несколько гидроксильных групп и карбонильную группу.
Электролит – это вещество, раствор или расплав которого проводит электрический ток.
Основная литература: Рудзитис, Г.Е., Фельдман, Ф.Г. Химия. 10 класс. Базовый уровень; учебник/ Г.Е. Рудзитис, Ф.Г, Фельдман – М.: Просвещение, 2018. – 224 с.
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс: учебное пособие для общеобразовательных организаций. Углубленный уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
Теоретический материал для самостоятельного изучения
Гидролиз органических соединений
Гидролизом называют реакцию обмена ионами между веществом и водой, в результате которой происходит разложение вещества и изменяется состояние окружающей среды. Например, реакция гидролиза сложных эфиров, которую вы уже знаете.
Гидролиз обратимой реакцией является. Для сдвига равновесия в сторону прямой реакции необходимо исчерпать один из продуктов реакции в другой реакции. Например, если проводить гидролиз в присутствии щелочи, кислота превратится в соль, которая не может участвовать в обратной реакции.
Гидролиз щелочью используется при производстве мыла из жиров.
Кислотным гидролизом полисахаридов, таких как крахмал и целлюлоза, можно получить глюкозу: (С6Н10О5)п + пН2О → пС6Н12О6
При нагревании белков в кислой или щелочной среде происходит гидролиз. Макромолекулы белков сначала распадаются на полипептиды, затем на крупные пептиды и, наконец, на мелкие пептиды. Аминокислоты являются конечным продуктом гидролиза белков. Ферменты осуществляют гидролиз белков в организмах. Благодаря этой реакции организм получает строительный материал для синтеза новых белков.
Гидролиз неорганических солей
В реакции гидролиза растворимых в воде солей, которые содержат хотя бы один слабый электролит, будет образовываться малодиссоциирующее соединение, в результате изменится pH среды.
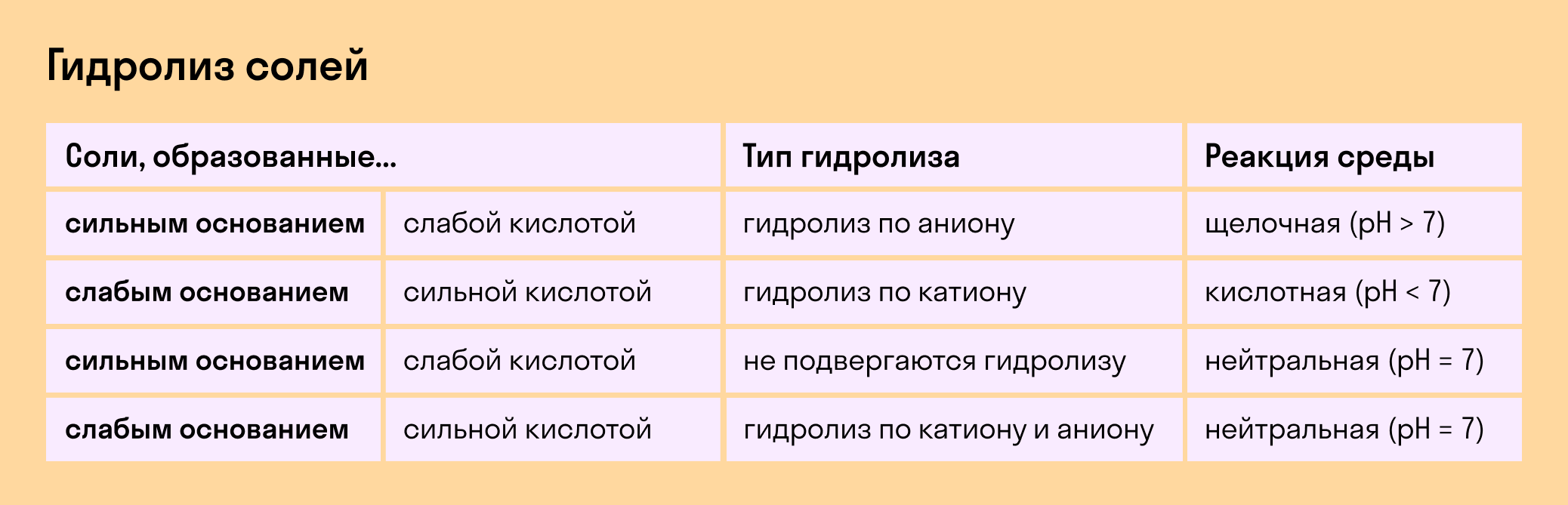
Соль представляет собой продукт взаимодействия кислоты и основания. В зависимости от силы электролитов, образующих соль, соли можно разделить на 4 группы:
1. Соль образуется от сильного основания и слабой кислоты: Na2CO3, K2S.
2. Соль образуется от слабого основания и сильной кислоты: CuSO4, NiCl2.
3. Соль образуется от слабого основания и слабой кислоты: Fe(CH3COO)3, (NH4)2CO3.
4. Соль образуется от сильного основания и сильной кислоты: NaCl, KNO3.
Молекулы воды состоят из положительного иона водорода и отрицательного иона гидроксила. Гидроксид натрия является сильным электролитом, поэтому натрий не реагирует с водой. Угольная кислота – слабый электролит, поэтому карбонаты взаимодействуют с водой и образуют гидрокарбонаты, делая среду щелочной.
Ион хлора не реагирует с молекулами воды, так как соляная кислота – сильный электролит. Железо будет взаимодействовать с водой, так как гидроксид железа (III) является слабым электролитом. Таким образом, образуется слабый гидроксокатион железа (III) и кислая среда.
Оба типа ионов взаимодействуют с молекулами воды и образуют слабые электролиты – гидроксокатион меди и уксусную кислоту.
Если соль образуется от сильного основания и сильной кислоты, то она не вступает в реакцию гидролиза, потому что в ней нет слабого электролита. Среда остаётся нейтральной.
Сдвиг равновесия в реакции гидролиза
Все рассмотренные реакции гидролиза являются обратимыми. Согласно принципу Ле Шателье равновесие химической реакции смещается. Например, добавление кислоты в раствор соли меди препятствует гидролизу, а добавление щелочи его усиливает.
Есть соли, которые нельзя растворить в воде — они полностью разлагаются на кислоты и основания. Это называется полным гидролизом: Cr2S3 + 6H2O → 2Cr(OH)3↓ + 3H2S↑.
Полным гидролизом подвергаются соли, образованные от слабых нерастворимых или нестойких оснований и слабых, неустойчивых или летучих кислот. В таких реакциях продукт гидролиза осаждается или выделяется из раствора в виде газа и не может участвовать в обратной реакции. Полный гидролиз является необратимым.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
Условие задачи: Сколько граммов мыла можно получить в результате гидролиза 150 г стеаратпальмитатолеат глицерина, если выход продукта составляет 85%? Ответ запишите в виде целого числа.
Шаг первый: Запишем уравнение реакции гидролиза стеаратпальмитатолеат глицерина.
Шаг второй: Найдем молярную массу жира.
М = 12·(17+15+17+6) +1·(35+31+33+5) + 16·6 = 860 (г/моль).
Шаг третий: Найдем молярные массы натриевых солей стеариновой, пальмитиновой и олеиновой кислот (мыла):
М (стеарат натрия) = 12·17 + 35 + 12 + 16·2 + 23 = 306 (г/моль);
М (пальмитат натрия) = 12·15 + 31 + 12 + 16·2 + 23 = 278 (г/моль);
М (олеат натрия) = 12·17 + 33 + 12 + 16·2 + 23 = 304 (г/моль).
Шаг четвёртый: Найдем массу каждой соли при 100%-ном выходе продукта. Для этого составим пропорцию:
Из 860 г жира образуется 306 г стеарата натрия;
из 150 г жира образуется х1 г стеарата натрия.
Из 860 г жира образуется 278 г пальмитата натрия;
из 150 г жира образуется х2 г пальмитата натрия.
Из 860 г жира образуется 304 г олеата натрия;
из 150 г жира образуется х3 г олеата натрия.
Шаг пятый: Найдем общую массу мыла при 100%-ном выходе продукта реакции. Для этого сложим массы стеарата, пальмитата и олеата натрия: 53 + 48 + 53 = 154 (г).
Шаг шестой: Найдем массу мыла при 85%-ном выходе продукта реакции.
Чтобы выполнить это, мы умножим найденную массу мыла на выход продукта и разделим на 100: т = 154 785 : 100 = 131 (г).
Ответ запишите с точностью до десятых долей.
В первом шаге: найдем концентрацию ионов водорода в 1 л раствора.
Для этого числовое значение ионов водорода разделим на 200 мл и умножим на 1000 мл (1 л = 1000 мл):
Во втором шаге: найдем значение рН этого раствора
Гидролиз
Понятие гидролиза
| Гидролиз — это процесс, при котором сложное химическое вещество взаимодействует с водой, в результате чего молекулы этого вещества разлагаются. Сам термин происходит от двух греческих слов: hydor, что означает «вода», и lysis, что означает «распад». |
Гидролиз подвергается как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т.д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью клетки организма расщепляют и усваивают жиры, белки и углеводы. Но сейчас мы займемся неорганической химией и рассмотрим гидролиз солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с ионами воды (H+ и OH-), что приводит к разложению исходного соединения. В результате этого ионного обмена образуется слабый электролит — кислота, щелочь или нейтральное соединение. |
Условия гидролиза
Несколько соединений не подвергаются разложению при реакции с молекулами воды. Здесь мы рассмотрим примеры солей и определим, какие из них подвергаются гидролизу, а какие нет и как это зависит.
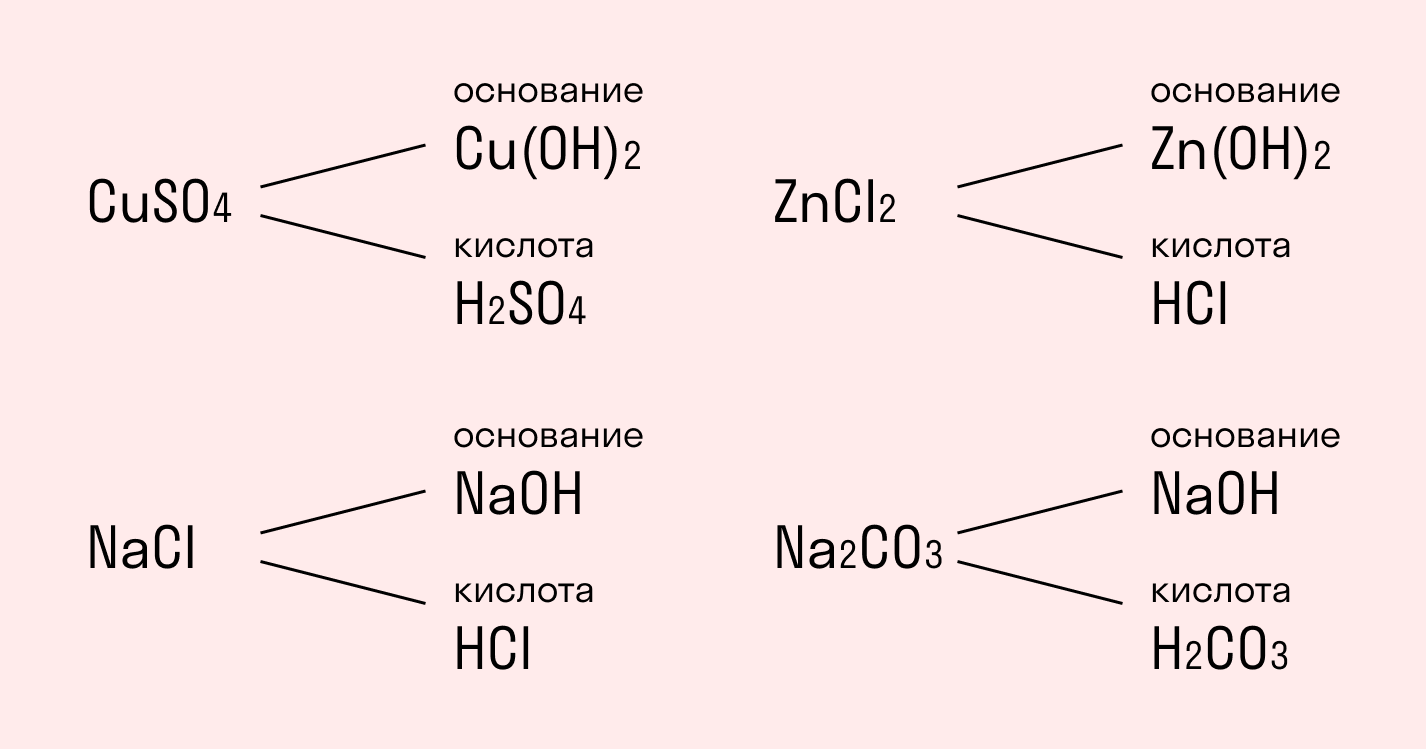
Будем начинать с того, что любое соль содержит амфотерный гидроксид как основание и кислотный остаток.
Сульфат меди CuSO4 состоит из основания Cu(ОН)2 и кислоты H2SO4;
Хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
Хлорид цинка ZnCl2 состоит из основания Zn(ОН)2 и кислоты HCI;
Карбонат натрия Na2CO3 состоит из основания NaOH и кислоты H2CO3.
В зависимости от того, содержит ли соль слабое основание или слабую кислоту, итоговая среда водного раствора может быть кислой, щелочной или нейтральной.
Что происходит, если соль состоит из сильного основания и сильного кислотного остатка? В этом случае ничего не происходит. 🙂 Сильные катионы и анионы такой соли не взаимодействуют с ионами воды. Таким образом, эта соль не разлагается и не подвержена гидролизу.
Схема гидролиза химической реакции выглядит следующим образом:
XY + HOH ↔ XH + HOY
XH — кислотный остаток;
Индикаторы среды раствора
Для быстрого определения среды раствора используются особые индикаторы, которые позволяют сделать это за считанные секунды. Одним из самых популярных индикаторов является лакмусовая бумага, но также широко используются фенолфталеин и метиловый оранжевый. В нейтральной среде эти индикаторы не меняют свой цвет, а в кислотной или щелочной среде они приобретают другую окраску.
Изменение цвета индикатора однозначно указывает на гидролиз. Однако, если индикатор остается таким же цветом, это не всегда означает отсутствие гидролиза. Например, если соль содержит слабое основание и слабую кислоту, то среда будет почти нейтральной. О таких случаях мы поговорим позже, а пока посмотрите таблицу ниже.
Виды гидролиза
Мы выяснили, что в составе соли может присутствовать слабый ион, который отвечает за гидролизацию. Он находится в основном компоненте, кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как уже известно, когда в соли присутствуют сильное основание и сильный кислотный остаток, она не разлагается при контакте с водой. Например, хлорид натрия (NaCl) не подвержен гидролизу, поскольку не содержит слабых ионов. Также сюда относятся соли вроде KClO4, Ba(NO3)2 и т. д.
Водный раствор среды является нейтральным (pH = 7).
Реакция индикаторов: они не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Раствор имеет кислую среду с pH меньше 7.
Фенолфталеин остается бесцветным, а лакмус и метиловый оранжевый краснеют при реакции.
Раствор соли, содержащей сильное основание и слабую кислоту
Раствор имеет щелочную среду с pH больше 7.
Фенолфталеин приобретает малиновый цвет, а лакмус — синий, а метиловый оранжевый желтеет.
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону возникает, когда оба компонента соли являются слабыми. В таком случае, как анион, так и катион переходят в реакцию с водой. Катион основания связывает ионы OH−, а анион кислоты связывает ионы H +.
Раствор имеет нейтральную, слабокислую или слабощелочную среду.
Реакция индикаторов может остаться без изменений.
Соль аммоний цианид является смесью слабого основания NH4OH и слабой кислоты HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
В данном случае раствор будет иметь слабощелочную среду.
Данные о гидролизе солей можно обобщить в таблице.
Ступенчатый гидролиз
Гидролиз может происходить ступенчато в случаях, когда с водой взаимодействуют соли с многозарядными катионами и анионами. Число ступеней зависит от числового заряда иона, ответственного за гидролиз.
Как определить число ступеней:
Если соль содержит слабую полидипротическую кислоту, то число ступеней равно количеству протонизируемых групп кислоты.
Если соль содержит слабое полиоснование, то число ступеней определяется числом протитанизируемых групп.
Рассмотрим гидролиз карбоната калия K2CO3. Карбонат — слабая многоосновная кислота H2CO3, поэтому процесс гидролиза будет идти по аниону на две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3. В результате образуется гидроксид калия (KOH) и кислая соль (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3. Получается тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для грубых приближенных расчетов обычно учитывают только результаты первой ступени.
Обратимый и необратимый гидролиз
Гидролиз химических веществ может быть обратимым или необратимым. В первом случае лишь некоторая доля частиц распадается, а во втором — практически все. Если соль полностью разлагается в воде, то это является необратимым процессом, известным как полный гидролиз.
Необратимость гидролиза наблюдается у солей, содержащих слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать только в сухом виде и не могут быть получены путем смешивания водных растворов других солей.
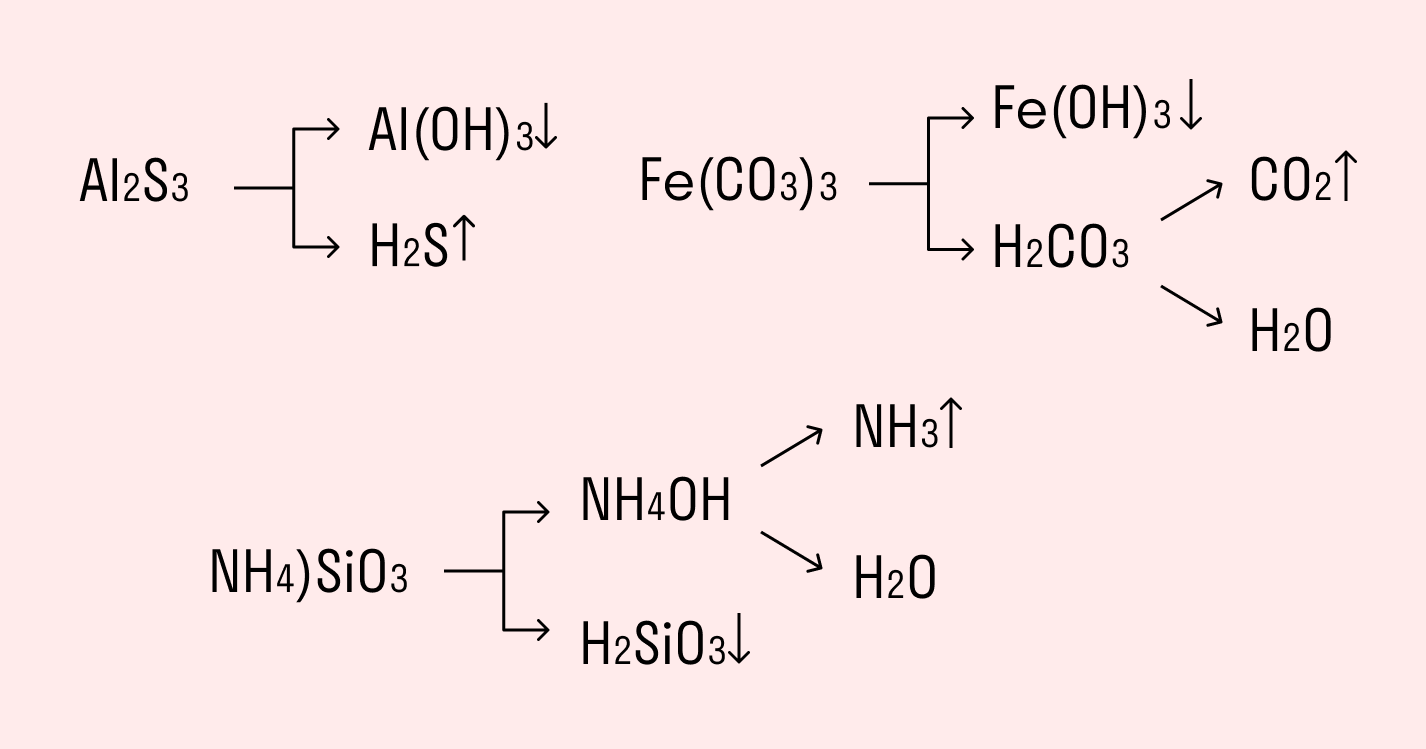
Например, сульфид алюминия подвергается полному гидролизу:
Как видите, в результате гидролиза образуются гидроксид алюминия и сероводород.
Необратимые реакции гидролиза также возможны в органической химии. Например, при полном гидролизе органического вещества — карбида кальция, образуется ацетилен:
Степень гидролиза
Взаимодействие соли или других химических соединений с водой может меняться в зависимости от нескольких факторов, что приводит к усилению или ослаблению гидролиза. Если нужно оценить степень гидролиза, то используется понятие его процентного значения, обозначаемого как h.
h — это степень гидролиза, которая выражается в процентах. Она определяется отношением количества гидролизованного вещества (обозначаемого как nгидр.) к общему количеству растворенного в воде вещества (обозначаемого как nобщ.).
Степень гидролиза может быть изменена такими факторами, как температура процесса, концентрация водного раствора и состав участвующих в гидролизе веществ.
Если нужно усилить гидролиз, то можно просто разбавить полученный раствор водой или повысить температуру. В более сложных случаях можно добавить в раствор вещество, которое способно связать один из продуктов гидролиза. Например, для соли со слабой кислотой и сильной основанием нужно добавить соль со слабым основанием и сильной кислотой.
Чтобы ослабить гидролиз, можно охладить или сделать более концентрированным раствор. Также можно изменить состав раствора: при гидролизации по катиону добавляют кислоту, а при гидролизации по аниону — щелочь.
Таким образом, мы рассмотрели, что такое гидролиз солей и какие факторы его влияют. Теперь пришло время проверить свои знания и ответить на вопросы по данной теме.
Вопросы для самопроверки:
Какое условие необходимо для проведения гидролиза?
Какие виды гидролиза вы можете назвать?
В каких случаях в результате гидролиза может образоваться слабощелочная или слабокислая среда?
Через какой процесс проходит гидролиз соли с сильным основанием и слабым кислотным остатком?
Для ослабления гидролиза соли с сильным основанием и слабой кислотой, нужно добавить в раствор? кислоту или щелочь?
Как влияет разбавление раствора водой на процесс гидролиза?
Как определяется количество степеней гидролиза?
Какая среда образуется при гидролизации следующих солей: NaF, KCl, FeBr2, Na2PO4? Ответ может быть несколько.
Какие из следующих солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответ может быть несколько.
Какая из следующих солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?