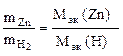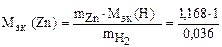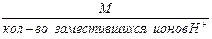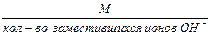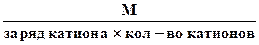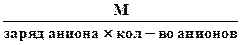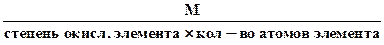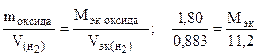Что такое эквивалентный вес
Эквивалентный вес
Эквивалентный вес — это весовое количество простого или сложного вещества, соединяющееся с 8 весовыми частями кислорода или 1,008 весовых частей водорода либо замещающее те же количества кислорода или водорода в их соединениях. Так как вещества реагируют друг с другом в весовых количествах, пропорциональных их эквивалентному весу, то химические расчеты удобно производить, используя эквивалентный вес. Грамм-эквивалентом называют массу вещества в граммах, численно равную эквивалентному весу этого вещества. См. также Концентрация, Титрование.
Эквивалентный вес (синоним химический эквивалент) — весовое количество простого или сложного вещества, равноценное в данной химической реакции 8 весовым частям кислорода или 1,008 весовой части водорода. Под словом «равноценное» понимают: замещает указанные выше количества кислорода или водорода (или соединяется с ними).
Численные величины эквивалентного веса данного вещества могут быть разными в зависимости от того, в какой химической реакции участвует это вещество. Так, например, эквивалентный вес серы в реакции образования сернистого ангидрида (S+O2=SO2) равен 1/4 атомного веса серы, а в реакции получения серного ангидрида (2S+3O2=2SO3) 1/6 ее атомного веса. Эквивалентный вес является удобной весовой единицей при количественном изучении химических реакций, поскольку одинаковые количества эквивалентов реагирующих веществ — это такие их весовые количества, которые взаимодействуют друг с другом нацело: например, один эквивалентный вес любой кислоты нейтрализует один эквивалентный вес любого основания, один эквивалентный вес любого окислителя окисляет один эквивалентный вес любого восстановителя и т. д. Граммэквивалентом вещества называют число граммов данного вещества, численно равное его эквивалентному весу.
Эквивалентный вес использует и как рассчитать его (с примерами)
Хотя на первый взгляд это может показаться немного сложным, некоторые вещества всегда ведут себя химически одинаково; следовательно, нетрудно узнать значения PE с учетом случаев.
Происхождение эквивалентного веса
Джон Далтон (1808) предложил эквивалентный вес водорода в качестве единицы массы. Однако возник ряд возражений против этого подхода. Например, было указано, что большинство элементов не реагируют непосредственно с водородом с образованием простых соединений (XH).
Кроме того, элементы с различными степенями окисления, например перманганат, имеют более чем эквивалентную массу. Это препятствовало принятию эквивалентного веса в качестве единицы массы.
Представление Дмитрием Менделеевым (1869) его периодической таблицы, в которой химические свойства элементов были связаны с упорядоченным порядком их атомных весов, представляло собой сильный аргумент тех, кто возражал против использования эквивалентного веса в качестве единицы масса.
На самом деле, нет необходимости использовать термин «эквивалент», так как любой стехиометрический расчет может быть сделан в терминах молей. Однако этот термин часто используется, и его не удобно игнорировать.
Для удобства был введен термин «эквивалент»: эквивалент любой кислоты реагирует с эквивалентом любого основания; Эквивалент любого окислителя реагирует с эквивалентом любого восстановителя и т. Д..
приложений
Использование в общей химии
металлы
Использование ПЭ в элементах и химических соединениях было заменено использованием его молярной массы. Основной причиной является наличие элементов и соединений с более чем эквивалентным весом.
Например, железо (Fe), элемент с атомным весом 55,85 г / моль, имеет две валентности: +2 и +3. Следовательно, он имеет два эквивалентных веса: когда он работает с валентностью +2, его эквивалентный вес составляет 27,93 г / экв; в то время как при использовании валентности +3 ее эквивалентный вес составляет 18,67 г / экв..
Конечно, мы не можем говорить о существовании эквивалентного веса Веры, но мы можем указать на существование атомного веса Веры..
кислоты
Тогда фосфорная кислота имеет до 3 эквивалентных весов. Но это не единичный случай, например, серная кислота имеет два эквивалентных веса, и углекислота также представлена.
Использовать в объемном анализе
-Чтобы уменьшить ошибки, которые могут быть допущены во время взвешивания веществ, использование вещества с более высокой эквивалентной массой является предпочтительным в аналитической химии. Например, при оценке растворов гидроксида натрия с кислотами разной эквивалентной массы. Рекомендуется использовать кислоту с большей эквивалентной массой.
-При использовании массы твердой кислоты, которая может реагировать с гидроксидом натрия, у вас есть возможность выбора между тремя твердыми кислотами: дигидрат щавелевой кислоты, фталевая кислота калия и гидройодат калия, с эквивалентными весами соответственно 63,04 г / экв, 204,22 г / экв и 389 г / экв.
В этом случае предпочтительно использовать перекись водорода калия при оценке гидроокиси натрия, так как относительная погрешность, которая допускается при ее взвешивании, ниже при наличии большей эквивалентной массы..
Использование в гравиметрическом анализе
Эквивалентный вес определяется по-своему в этой методике для анализа веществ. Здесь масса осадка соответствует одному грамму аналита. Это элемент или соединение, представляющее интерес в проводимом исследовании или анализе.
В гравиметрии часто называют результаты анализов в виде доли массы аналита, часто выражаемой в процентах..
Коэффициент эквивалентности объясняется как численный коэффициент, на который умножается масса осадка для получения массы аналита, обычно выражаемой в граммах..
Гравиметрическое определение никеля
Например, при гравиметрическом определении никеля содержащий его осадок представляет собой бис (диметилглиоксилат) никеля с молярной массой 288,915 г / моль. Молярная масса никеля составляет 58,6934 г / моль.
Молярная масса осадка между молярной массой никеля дает следующий результат:
Используется в химии полимеров
В химии полимеров эквивалентный вес реагента для полимеризации представляет собой массу полимера, который имеет эквивалент реакционной способности.
Это особенно важно в случае ионообменных полимеров: один эквивалент ионообменного полимера может обменивать один моль заряженных ионов; но только половина моль двухзарядных ионов.
Обычно реакционную способность полимера выражают в виде обратной величины эквивалентной массы, которая выражается в единицах ммоль / г или мэкв / г..
Как рассчитать это? примеров
-Эквивалентный вес химического элемента
Он получается путем деления его атомного веса на его валентность:
Есть элементы, которые имеют только эквивалентный вес, и элементы, которые могут иметь 2 или более.
Эквивалентный вес кальция
Атомный вес = 40 г / моль
20 г / экв
Эквивалентный вес алюминия
Атомный вес = 27 г / моль
9 г / экв
Никель эквивалентный вес
Атомный вес = 58,71 г / моль
Никель имеет два эквивалентных веса, соответствующих тому, когда он реагирует с валентностью +2 и когда он реагирует с валентностью +3.
29,35 г / экв
19,57 г / экв
-Эквивалентная масса оксида
Один из способов расчета эквивалентной массы оксида состоит в делении его молекулярной массы на произведение валентности металла на индекс металла.
Pm = молекулярная масса оксида.
S = металлический индекс
Продукт V · S называется общим или чистым зарядом катиона..
Эквивалентная масса оксида алюминия (Al2О3)
Молекулярный вес = Al (2 х 27 г / моль) + O (3 х 16 г / моль)
17 г / экв
Существует еще один способ решения этой проблемы, основанный на стехиометрии. В 102 г оксида алюминия содержится 54 г алюминия и 48 г кислорода..
Peq del Al = Атомный вес / Валенсия
На основании эквивалентного веса алюминия (9 г / экв.) Рассчитано, что в 54 г алюминия содержится 6 эквивалентов алюминия..
Тогда из свойств эквивалентов: 6 эквивалентов алюминия будут реагировать с 6 эквивалентами кислорода с образованием 6 эквивалентов оксида алюминия..
В 102 г. оксида алюминия есть 6 эквивалентов.
Peq of Al2О3 = 102 г / 6 экв
17 г / экв
-Эквивалентный вес базы
Эквивалентный вес получают путем деления его молекулярного веса на количество оксигидрильных групп (ОН).
Эквивалентная масса гидроксида железа, Fe (ОН)2
Молекулярный вес = 90 г / моль
45 г / экв
-Эквивалентный вес кислоты
Как правило, его получают путем деления его молекулярной массы на количество водорода, который выделяется или выделяется. Однако полипротонные кислоты могут диссоциировать или высвобождать Н в различных формах, поэтому они могут иметь более чем эквивалентную массу..
Эквивалентная масса соляной кислоты, HCl
Эквивалентная масса HCl = молекулярная масса / водородное число
36,5 г / экв
Эквивалентная масса серной кислоты
Серная кислота (ч2SW4) может быть разделена двумя способами:
Когда вы выпускаете H + Ваш PE это:
Молекулярный вес = 98 г / моль
98 г / пек
И когда он выпускает 2H + :
Молекулярный вес = 98 г / моль
49 г / экв
По той же причине фосфорная кислота (H3ПО4) с молекулярной массой 98 г / моль, может иметь до трех эквивалентных масс: 98 г / экв, 49 г / экв и 32,67 г / экв.
-Эквивалентный вес соли
И, наконец, вы можете рассчитать эквивалентную массу соли, разделив ее молекулярную массу на произведение валентности металла на индекс металла.
СОДЕРЖАНИЕ
В истории
Эквивалентные веса не обходились без проблем. Во-первых, шкала на основе водорода не была особенно практичной, поскольку большинство элементов не реагируют напрямую с водородом с образованием простых соединений. Однако один грамм водорода реагирует с 8 граммами кислорода с образованием воды или с 35,5 граммами хлора с образованием хлористого водорода : следовательно, 8 граммов кислорода и 35,5 граммов хлора могут быть приняты как эквивалентные одному грамму водорода для измерения. эквивалентных весов. Эта система может быть расширена с помощью различных кислот и оснований.
Использование в общей химии
В некоторых современных учебниках общей химии об эквивалентных весах не упоминается. Другие объясняют тему, но указывают, что это просто альтернативный метод проведения расчетов с использованием молей.
Использование в объемном анализе
В качестве примера предполагается, что 22,45 ± 0,03 см 3 раствора гидроксида натрия реагирует с 781,4 ± 0,1 мг иодата калия. Поскольку эквивалентная масса иодата калия составляет 389,92 г, измеренная масса составляет 2,004 миллиэквивалента. Таким образом, концентрация раствора гидроксида натрия составляет 2,004 мэкв / 0,02245 л = 89,3 мэкв / л. В аналитической химии раствор любого вещества, который содержит один эквивалент на литр, известен как нормальный раствор (сокращенно N ), поэтому пример раствора гидроксида натрия будет 0,0893 Н. Относительная погрешность ( u r ) измеренной концентрации может быть равна оценивается в предположении распределения Gaussian из неопределенности измерений :
Этот раствор гидроксида натрия можно использовать для измерения эквивалентной массы неизвестной кислоты. Например, если для нейтрализации 61,3 ± 0,1 мг неизвестной кислоты требуется 13,20 ± 0,03 см 3 раствора гидроксида натрия, эквивалентный вес кислоты составляет:
эквивалентный вес знак равно м кислота c ( NaOH ) V экв знак равно 52,0 ± 0,1 грамм <\ displaystyle <\ text <эквивалентный вес>> = <\ frac
Поскольку каждый моль кислоты может высвободить только целое число молей ионов водорода, молярная масса неизвестной кислоты должна быть целым числом, кратным 52,0 ± 0,1 г.
Использование в гравиметрическом анализе
Использование в химии полимеров
Это особенно важно для ионообменных полимеров (также называемых ионообменными смолами): один эквивалент ионообменного полимера обменивает один моль однозарядных ионов, но только половину моля двухзарядных ионов.
Тем не менее, учитывая сокращение использования термина «эквивалентный вес» в остальной химии, стало более обычным выражать реакционную способность полимера как обратную эквивалентную массу, то есть в единицах ммоль / г или мэкв. /грамм.
СОДЕРЖАНИЕ
В истории
Эквивалентные веса не обходились без проблем. Во-первых, шкала на основе водорода не была особенно практичной, поскольку большинство элементов не реагируют напрямую с водородом с образованием простых соединений. Однако один грамм водорода реагирует с 8 граммами кислорода с образованием воды или с 35,5 граммами хлора с образованием хлористого водорода : следовательно, 8 граммов кислорода и 35,5 граммов хлора могут быть приняты как эквивалентные одному грамму водорода для измерения. эквивалентных весов. Эта система может быть расширена с помощью различных кислот и оснований.
Использование в общей химии
В некоторых современных учебниках общей химии об эквивалентных весах не упоминается. Другие объясняют тему, но указывают, что это просто альтернативный метод проведения расчетов с использованием молей.
Использование в объемном анализе
В качестве примера предполагается, что 22,45 ± 0,03 см 3 раствора гидроксида натрия реагирует с 781,4 ± 0,1 мг иодата калия. Поскольку эквивалентная масса иодата калия составляет 389,92 г, измеренная масса составляет 2,004 миллиэквивалента. Таким образом, концентрация раствора гидроксида натрия составляет 2,004 мэкв / 0,02245 л = 89,3 мэкв / л. В аналитической химии раствор любого вещества, который содержит один эквивалент на литр, известен как нормальный раствор (сокращенно N ), поэтому пример раствора гидроксида натрия будет 0,0893 Н. Относительная погрешность ( u r ) измеренной концентрации может быть равна оценивается в предположении распределения Gaussian из неопределенности измерений :
Этот раствор гидроксида натрия можно использовать для измерения эквивалентной массы неизвестной кислоты. Например, если для нейтрализации 61,3 ± 0,1 мг неизвестной кислоты требуется 13,20 ± 0,03 см 3 раствора гидроксида натрия, эквивалентный вес кислоты составляет:
эквивалентный вес знак равно м кислота c ( NaOH ) V экв знак равно 52,0 ± 0,1 грамм <\ displaystyle <\ text <эквивалентный вес>> = <\ frac
Поскольку каждый моль кислоты может высвободить только целое число молей ионов водорода, молярная масса неизвестной кислоты должна быть целым числом, кратным 52,0 ± 0,1 г.
Использование в гравиметрическом анализе
Использование в химии полимеров
Это особенно важно для ионообменных полимеров (также называемых ионообменными смолами): один эквивалент ионообменного полимера обменивает один моль однозарядных ионов, но только половину моля двухзарядных ионов.
Тем не менее, учитывая сокращение использования термина «эквивалентный вес» в остальной химии, стало более обычным выражать реакционную способность полимера как обратную эквивалентную массу, то есть в единицах ммоль / г или мэкв. /грамм.
Эквиваленты и эквивалентные массы



Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как «эквивалент», и установлению закона эквивалентов: массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы.
Математическое выражение закона эквивалентов:
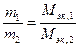
Из этого определения видно, что понятие «эквивалент» относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
Относительная масса эквивалента называется эквивалентной массой, а масса одного моля эквивалентов, выраженная в граммах, называется молярной эквивалентной массой; она обозначается Мэк, единица измерения – моль эк/г, она численно равна относительной молекулярной массе эквивалента.
Пример 5. Определить эквивалент, эквивалентную массу и молярную массу эквивалента кислорода в молекуле воды.
Решение. Такая формулировка вопроса предполагает реакцию образования воды из кислорода и водорода H2 + ½O2 = Н2О, в которой с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Атомная масса кислорода равна 16. Эквивалентом кислорода является ½ его атома, эквивалентная масса равна 8, а молярная масса эквивалента равна 8 г/ моль.
Эквивалентное число серы в этих оксидах равно 4 и 6, т.е. оно равно степени окисления (стехиометрической валентности) серы в этих соединениях. Таким образом, относительная эквивалентная масса и численно равная ей молярная масса элемента в соединении вычисляется по формуле:
Мэк (элемента) = 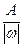
Например, Z(Mn) в соединении KMnO4 составляет 7(w = +7), а Мэк (Mn)=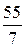
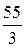
Эквивалентная масса вещества имеет различные значения в зависимости от того, в какой химической реакции участвует это вещество. При расчете эквивалентных масс можно пользоваться следующими правилами и формулами.
1. Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
Мэк кислоты =
2. Эквивалентная масса основания в реакции замещения гидроксид-ионов равна:
Мэк основания =
Пример 6. Определить эквивалентную массу H2SO4 в реакциях:
Решение. В реакции 1 замещён один ион водорода, следовательно, эквивалентное число серной кислоты Z(H2SO4) = 1, Мэк(H2SO4) = 98 г/моль эк. В реакции 2 заместились оба иона водорода, следовательно, эквивалентное число Z(H2SO4) = 2, а Mэк(H2SO4) = 49 г/моль эк.
Пример 7. Определить эквивалентную массу гидроксида висмута в реакциях:
3. Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Мэк. соли =
или Мэк соли =
4. Эквивалентная масса оксида в реакциях полного замещения равна
Мэк оксида =
Например, Z(Fe2O3) = 3 × 2 = 6, Мэк = М(Fe2O3) = 160 : 6 = 26,6 г/моль эк. Но в реакции
Z(Fe2O3) = 4, Мэк(Fe2O3) = 160 : 4 = 40 г/моль эк, т.к. одна формульная единица Fe2O3 взаимодействует с четырьмя эквивалентами HCl.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 л/моль эк (так как Мэк(Н) = 1 г/моль эк), а для кислорода – 5,6 л/моль эк (так как Мэк(О) = 8 г/моль эк).
Пример 8. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов, массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
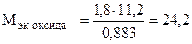
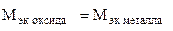
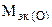
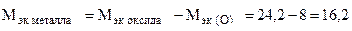
Пример 9. Вычислить эквивалентную массу цинка, если 1,168 г этого металла вытеснили из кислоты 438 мл Н2 (Т = 17 °С и Р = 750 мм рт. ст.).
Решение. 1) По уравнению Клапейрона–Менделеева вычисляем массу водорода:
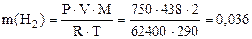
Согласно закону эквивалентов